
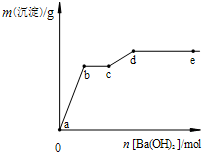
 在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )
在含有4mol HCl和1mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,下列说法正确的是( )| A、a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B、b→c时发生的离子反应为:H++OH-→H2O |
| C、c→d时离子的物质的量:Ba2+可能大于Cl- |
| D、d→e时离子的物质的量:Ba2+一定大于OH- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 一定条件 |
| n(CH3OH) |
| n(CO2) |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的导电性差 |
| B、在溶液中离子与离子间存在电离平衡 |
| C、溶解度小 |
| D、在溶液中存在分子和离子之间的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
| B、2 g氢气所含原子数目为NA |
| C、在常温常压下,11.2 L氮气所含的原子数目为NA |
| D、17 g氨气所含电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60克SiO2含有2NA个Si-O共价键 |
| B、1.0L 1.0mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入氯气,溶液中氢离子浓度增大 |
| B、通入过量H2S,反应后溶液pH减小 |
| C、加入氢氧化钠溶液,平衡向右移动,pH变小 |
| D、加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H-)降低 |
| C、向水中加入少量固体氢氧化钠,平衡正向移动,c(H-)降低 |
| D、将水加热,KW增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com