
(10��)ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
| ��ѧ�� | Cl��Cl | H��H | H��Cl | N��N |
| ����/kJ��mol | 243 | 436 | 431 | 946 |
 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(10��)ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
| ��ѧ�� | Cl��Cl | H��H | H��Cl | N��N |
| ����/kJ��mol | 243 | 436 | 431 | 946 |
��1����Ҫ��������
a 2HCl(g) �� H2(g)��Cl2(g)����H=
b N2 (g)+3H2(g) =2NH3(g) ��H=-92kJ/mol����N��H���ļ����� kJ��mol
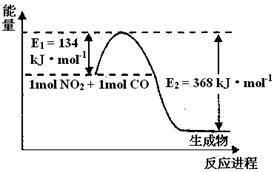
��2��1 mol NO2��1molCO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ
��3�� ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)=CO(g) + 2H2O(l)��H = ���ú���H1����H2����H3��ʽ�ӱ�ʾ��
(4) ��֪��2Al (s)+ 3/2O2��g��==Al2O3(s) ��H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2��g��==Fe2O3(s) ��H= -815.88 kJ• mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�����ʡͨ����������ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
(10��)��A��B��C��D��E��F����Ԫ�أ���֪��
������λ��������ͬ�����ڣ��˵������������ ��B��Fͬ���塣
��B��C�ֱ�����D��ԭ�Ӹ�����1��1��1��2�γɻ����
��A��E�ֱ�����D��ԭ�Ӹ�����1��1��2��1�γɻ����
��EԪ�صĵ������������� (kJ��mol��1)��
| I1 | I2 | I3 | I4 | �� |
| 496 | 4562 | 6912 | 9540 | �� |
| ��ѧ�� | F��D | F��F | B��B | F��B | C��D | D��D |
| ����/kJ��mol��1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
(10��)��A��B��C��D��E��F����Ԫ�أ���֪��
������λ��������ͬ�����ڣ��˵������������ ��B��Fͬ���塣
��B��C�ֱ�����D��ԭ�Ӹ�����1��1��1��2�γɻ����
��A��E�ֱ�����D��ԭ�Ӹ�����1��1��2��1�γɻ����
��EԪ�صĵ������������� (kJ��mol��1)��
|
I1 |
I2 |
I3 |
I4 |
�� |
|
496 |
4562 |
6912 |
9540 |
�� |
(1)д��ֻ����A��B��D��E����Ԫ�ص�������ˮ�εĻ�ѧʽ__________��__________��
(2)B2A2�����д���______���Ҽ���______���м���
(3)����ͨ���Ѳ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�������ڼ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)����ѧ��Ӧ�Ħ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ�±��г�����������Ԫ���γɵĻ�ѧ���ļ��ܣ�
|
��ѧ�� |
F��D |
F��F |
B��B |
F��B |
C��D |
D��D |
|
����/kJ��mol��1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
�Լ���1 mol F���ʾ���ȼ��ʱ�ķ�Ӧ�Ȧ�H=_____ (Ҫд��λ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ӱ�ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(10��)ͨ�����ǰѲ�1mol ij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
|
��ѧ�� |
Cl��Cl |
H��H |
H��Cl |
N��N |
|
����/kJ��mol |
243 |
436 |
431 |
946 |
��1����Ҫ��������
a 2HCl(g) �� H2(g)��Cl2(g)����H=
b N2 (g)+3H2(g) = 2NH3(g) ��H=-92 kJ/mol����N��H���ļ����� kJ��mol
��2��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ

��3�� ��֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2
�� H2O(g) �� H2O(l) ��H3
��CH3OH(l)��O2(g)= CO(g) + 2H2O(l)��H = ���ú���H1����H2����H3��ʽ�ӱ�ʾ��
(4) ��֪��2Al (s)+ 3/2O2��g��==Al2O3(s) ��H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2��g��==Fe2O3(s) ��H= -815.88 kJ• mol-1
��д����������������ĩ�������ȷ�Ӧ���Ȼ�ѧ����ʽ_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com