
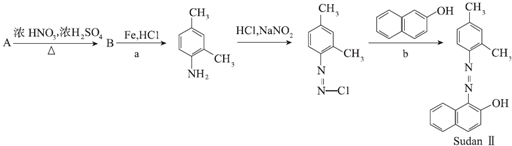
 .
. .②E→Fn
.②E→Fn +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$ +2nH2O.
+2nH2O. 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%. 分析 根据题中各物质转化关系,A为二甲苯的一种同分异构体,根据可知A为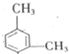 ,A发生硝化反应得B为
,A发生硝化反应得B为 ,B发生还原反应得产物
,B发生还原反应得产物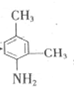 ,所以反应a为还原反应,比较
,所以反应a为还原反应,比较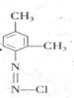 和
和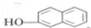 以及Sudan的结构,根据元素守恒可知,反应b生成的小分子为HCl,C为芳香族化合物,与A互为同分异构体,含有两个互不相邻的取代基,则C为
以及Sudan的结构,根据元素守恒可知,反应b生成的小分子为HCl,C为芳香族化合物,与A互为同分异构体,含有两个互不相邻的取代基,则C为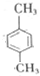 ,D是C的一氯取代产物中一种,苯环上含有三个取代基,则D为
,D是C的一氯取代产物中一种,苯环上含有三个取代基,则D为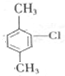 ,D与酸性高锰酸钾溶液反应得E,E在一定条件下能与乙二醇反应生成高分子化合物F,则E是二元酸,所以E为
,D与酸性高锰酸钾溶液反应得E,E在一定条件下能与乙二醇反应生成高分子化合物F,则E是二元酸,所以E为 ,F为
,F为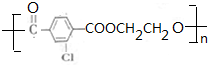 ,比较M和
,比较M和 的结构可知G的结构简式为
的结构可知G的结构简式为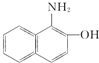 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,A为二甲苯的一种同分异构体,根据可知A为 ,A发生硝化反应得B为
,A发生硝化反应得B为 ,B发生还原反应得产物
,B发生还原反应得产物 ,所以反应a为还原反应,比较
,所以反应a为还原反应,比较 和
和 以及Sudan的结构,根据元素守恒可知,反应b生成的小分子为HCl,C为芳香族化合物,与A互为同分异构体,含有两个互不相邻的取代基,则C为
以及Sudan的结构,根据元素守恒可知,反应b生成的小分子为HCl,C为芳香族化合物,与A互为同分异构体,含有两个互不相邻的取代基,则C为 ,D是C的一氯取代产物中一种,苯环上含有三个取代基,则D为
,D是C的一氯取代产物中一种,苯环上含有三个取代基,则D为 ,D与酸性高锰酸钾溶液反应得E,E在一定条件下能与乙二醇反应生成高分子化合物F,则E是二元酸,所以E为
,D与酸性高锰酸钾溶液反应得E,E在一定条件下能与乙二醇反应生成高分子化合物F,则E是二元酸,所以E为 ,F为
,F为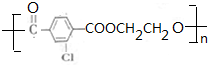 ,比较M和
,比较M和 的结构可知G的结构简式为
的结构可知G的结构简式为 ,
,
(1)根据上面的分析可知,a反应所属反应类型为还原反应,b反应生成的另一小分子是HCl,
故答案为:还原反应;HCl;
(2)根据上面的分析可知,B的结构简式为 ,故答案为:
,故答案为: ;
;
(3)C为 ,C的一氯取代产物最多可能有2种,E为
,C的一氯取代产物最多可能有2种,E为 ,F为
,F为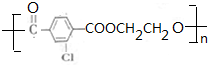 ,①E与过量热NaOH溶液反应为
,①E与过量热NaOH溶液反应为 ,②E→F反应的化学方程式为n
,②E→F反应的化学方程式为n +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$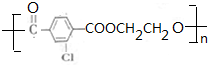 +2nH2O,
+2nH2O,
故答案为:2; ;n
;n +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$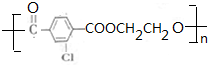 +2nH2O.
+2nH2O.
(4)G的结构简式为 ,其分子式是C10H9NO,氮元素的质量分数为$\frac{14}{159}$×100%=8.8%,
,其分子式是C10H9NO,氮元素的质量分数为$\frac{14}{159}$×100%=8.8%,
故答案为:8.8%.
点评 本题考查有机物的推断与合成,难度中等,注意对题目反应信息的理解利用,根据有机物的结构特点用正推和逆推法推断有机物.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
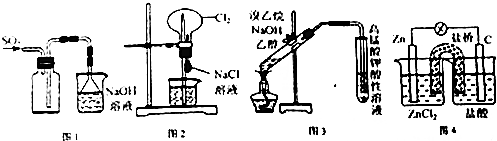
| A. | 用图1装置可以收集SO2 | |
| B. | 用图2装置可以完成“喷泉”实验 | |
| C. | 用图3装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| D. | 用图4装置可以实现化学反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | B. | 2Fe+2H2O+O2═2Fe(OH)2 | ||
| C. | 2H2O+O2+4e-→4OH- | D. | Fe→Fe3++3e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
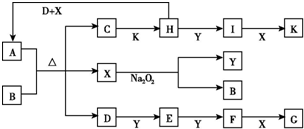 如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题:
如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 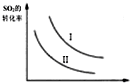 如图研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 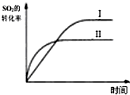 如图研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. |  图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 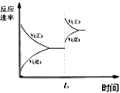 图中t0时增大压强,使平衡向负反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玉是石灰石 | B. | 玉的硬度比河砂大 | ||
| C. | 玉的熔点较高 | D. | 玉是金刚砂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子结构示意图: | |
| B. | 氯化氢分子的电子式: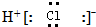 | |
| C. | 乙烯分子的结构式:CH2=CH2 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=2 Fe3++3SO42ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com