
| A. | AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-═Ag2S↓ | |
| B. | 向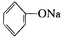 溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- 溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
分析 A.二者反应生成硫化银沉淀和硝酸钠;
B.二氧化碳与苯酚钠溶液反应生成苯酚和碳酸氢钠;
C.醋酸为弱酸,应保留化学式;
D.亚硫酸氢钠少量,反应生成亚硫酸钡沉淀、氢氧化钠和水;
解答 解:A.AgNO3溶液滴入少量的Na2S溶液,离子方程式:2Ag++S2-═Ag2S↓,故A正确;
B.向 溶液中通入少量CO2离子方程式:C6H5O-+CO2+H2O→C6H5OH+NHCO3-,故B正确;
溶液中通入少量CO2离子方程式:C6H5O-+CO2+H2O→C6H5OH+NHCO3-,故B正确;
C.向Na2CO3溶液中加入过量CH3COOH溶液,离子方程式:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO-,故C错误;
D.向Ba(OH)2溶液中加入少量的NaHSO3溶液,离子方程式:HSO3-+Ba2++OH-═BaSO3↓+H2O,故D错误;
故选:AB.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、注意反应物用量对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶液在电流作用下电离成钾离子和氯离子 | |
| B. | 二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质 | |
| C. | 纯净的电解质在液态时,有的导电有的不导电 | |
| D. | 硫酸钡难溶于水,所以硫酸钡属弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:2:3 | B. | 5:2:2 | C. | 9:3:1 | D. | 9:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-、Cl-、Br-、I- | B. | S2-、Ca2+、Ar、Cl- | ||
| C. | Na+、K+、Mg2+、Al3+ | D. | Mg2+、Mg、Al3+、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
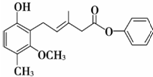
| A. | 该化合物既可以催化加氢,又可以在光照下与Cl2发生取代反应 | |
| B. | 该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色 | |
| C. | 该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2 | |
| D. | 1 mol该化合物最多可以与3mol NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com