
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
分析 短周期元素A、B、C、D四种元素,D元素原子的次外层电子数等于其他层电子数之和,由位置可知D位于第三周期,则次外层电子数为8,M层电子数为8-2=6,则D为S,B为O,结合位置关系A为N,C为F,E2+与D的简单阴离子有相同的电子层结构,则E为Ca,然后结合元素化合物性质来解答.
解答 解:短周期元素A、B、C、D四种元素,D元素原子的次外层电子数等于其他层电子数之和,由位置可知D位于第三周期,则次外层电子数为8,M层电子数为8-2=6,则D为S,B为O,结合位置关系A为N,C为F,E2+与D的简单阴离子有相同的电子层结构,则E为Ca,
A.F的非金属性最强,可与Ca元素形成离子化合物,但是与N形成共价化合物,故A错误;
B.S对应的酸有亚硫酸、硫酸、氢硫酸,硫酸根离子不能促进水的电离,故B错误;
C.C单质是F2,F2会与水反应,不能从D、E组成的化合物的水溶液中置换出D,故C错误;
D.电子层越多,半径越大,电子层结构相同时,序数小半径反而大,
D的离子是S2-(3层、16号),E的离子是Ca 2+(3层、20号),A的离子是N 3-(2层、7号),B的离子是O 2-(2层、8号),C的离子是F-(2层、9号),
则离子半径由大到小的排列顺序为:D>E>A>B>C,故D正确;
故选:D.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素周期表结构、元素周期律内容为解答的关键,注意氟气与水的反应,题目难度不大.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为79、质子数为55 的铯(Cs)原子:${\;}_{55}^{79}$Cs | |
| B. | N2分子的电子式: | |
| C. | HOCH2COOH缩聚物的结构简式: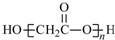 | |
| D. | 镁离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯( 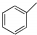 )的一氯代物 )的一氯代物 | D. | 立体烷 (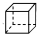 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com