
【题目】某元素的原子最外层只有一个电子,其原子与卤素原子结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键也可能是共价键
D.以上说法都不正确
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作名称是_____,该操作用到的玻璃仪器是_____
A.烧杯 B.漏斗 C.酒精灯 D.玻璃棒
(2)固体X是_____(填化学式),溶液Y是_____(填化学式)
(3)步骤2中发生反应的离子方程式为 _____ 。
(4)将回收的铜和一定浓度的稀硫酸混合后在加热的情况下通入氧气,发生反应:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
2CuSO4+2H2O中,氧化剂是________,还原剂是_______。用单线桥法标出上述反应的电子得失:______________________。
(5)步骤4中涉及的操作是:蒸发浓缩、___________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A. 电极a上发生的电极反应式为:H2S - 2e- = S+2H+
B. 电池工作时,电流从电极b经过负载流向电极a
C. 电路中每流过1 mol电子,电池内部释放158 kJ的热能
D. 每11.2 LH2S参与反应,有1 mol H+经固体电解质膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氧磷(POCl3)可用作有机合成的氯化剂和催化剂,实验室制取POCl3并测定产品含量的实验过程如下:
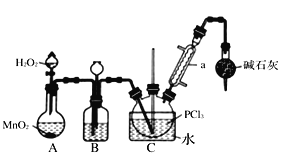
I.制备POCl3可用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略)及相关信息如下。
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其 他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)装MnO2的仪器名称是__________;干燥管的作用为_________________________。
(2)装置B中的液体药品是_____;装置B有三个作用,分别为______________________。
(3)三氯化氧磷还可由三氯化磷与水、氯气反应制备。此方法生产三氯化氧磷的化学方程式为____________________________________。
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待反应器中液体冷却到室温,准确称取一定质量的 POCl3产品(杂质不含氯元素),置于盛有100.00 mL蒸馏水的烧杯中摇动至完全水解,将水解液配成200.00 mL溶液
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 1.5 mol/L AgNO3标准溶液
③加入少量硝基苯,用力摇动,静置
④加入指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去15.00 mL KSCN溶液。
(4)选择的指示剂为___________。
(5)测得产品中n(POCl3)= ___________________________。(已知:磷酸银可溶于酸)
(6)已知Ksp(AgCl)> Ksp(AgSCN),步骤③的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ、某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
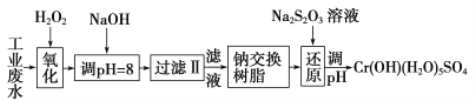
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是_________(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是________(填序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+ E.Fe2+
Ⅱ、酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?____(填“能”或“不能”)。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,月球上有大量3He存在,以下关于3He的说法正确的是( )
A.是4He的同素异形体
B.是4He的同位素
C.比4He少一个电子
D.比4He少一个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某铁盐含三种元素,为了探究其组成并将之转化为硫酸铁,设计了如下实验:

请回答:
(1)铁盐X的化学式为________________,气体乙的化学式为________________。
(2)写出溶液A中加入H2O2后发生反应的离子方程式______________________。
(3)由溶液B制备纯净硫酸铁的一系列操作为:蒸发浓缩、______、过滤、洗涤、干燥。
(4)为确保溶液A到B反应完全,需要检验B溶液中有无Fe2+残留,请设计简单的实验:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com