
����Ŀ��ͼ����CO2�����ԭΪ̼�⻯���CxHy���Ĺ���ԭ��ʾ��ͼ����ij����ˮ��Һ�����Һ��ͼ�� ����H2��ԭCO2�Ʊ��״��Ĺ���ԭ��ʾ��ͼ��������Ϊ�������Һ������˵���в���ȷ������ ��
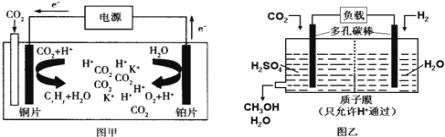
A������ͭƬ��������K+��ͭƬ�缫�ƶ�
B��������CxHyΪC2H4��������1mol C2H4��ͬʱ����3mol O2
C������H2SO4����������ǿ��Һ�ĵ�����
D���������������ĵ缫��ӦΪCO2+5e-+6H+�TCH3OH+H2O
���𰸡�D
��������
���������A�����ݵ����ƶ��ķ���ͭƬΪ��������ƬΪ������������������������ƶ�����˵����ȷ��B��������ӦʽΪ��2H2O��4e��=O2����4H����������ӦʽΪ2CO32����16H����12e��=C2H4��6H2O����ʧ������Ŀ�غ㣬�������1molC2H4��ͬʱ����3molO2����˵����ȷ��C�������������������ǿ������������˵����ȷ��D��ͨCO2��һ��Ϊ��������ӦʽΪCO2��6H����6e��=CH3OH��H2O����˵������


 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������仯�����ڹ�ũҵ����������������Ҫ���ã���������������:
��1����CH4����ԭNOx�������������������Ⱦ������:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1=-574 kJ mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H2
��2 molCH4��ԭNO2��N2�����������зų�������Ϊ1734 kJ������H2=_________��
��2���ݱ�������ѧ����һ������������Fe2O3�����鷴Ӧ����ȡ���������Ľ��������䷴Ӧ���£�Fe2O3(s)+3CH4(g)===2Fe(s)+3CO(g)+6H2(g) ��H>0
�� ����Ӧ��5 L���ܱ������н�����1 min��ﵽƽ�������Fe2O3�ڷ�Ӧ����������3.2g�����ö�ʱ����CO��ƽ����Ӧ����Ϊ__________mol/(L��s)
�� ���÷�Ӧ�����º�ѹ�����н������������÷�Ӧ�ﵽƽ��״̬����__________(ѡ����ţ�
A��CH4��ת��������CO�IJ���
B����������ƽ����Է�����������
c��v(CO)��v(H2)�ı�ֵ����
D�����������������
���÷�Ӧ�ﵽƽ��ʱij���������¶ȱ仯��ͼ��ʾ�����¶���T1���ߵ�T2ʱ��ƽ�ⳣ��KA________KB(����>������<������=��)����������ʾ��������������__________(����ĸ)��
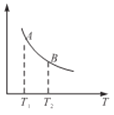
A��H2���淴Ӧ����
B��CH4�ĵ�������
C����������ƽ����Է�������
D��CO���������
��3����һЩ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��ʵ�ְ��ĵ绯ѧ�ϳɣ��Ӷ��������˵�����������ת���ʡ��绯ѧ�ϳɰ����̵��ܷ�ӦʽΪN2��3H2![]() 2NH3������������ԭ��Ӧ�ķ���ʽΪ________________��
2NH3������������ԭ��Ӧ�ķ���ʽΪ________________��
��4������20 mL0.01mol/L������HNO2��Һ���������һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯����ͼ��ʾ�������й�˵����ȷ����_____________(����)
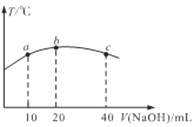
�����ռ���Һ��Ũ��Ϊ0.02mol/L
�����ռ���Һ��Ũ��Ϊ0.01mol/L
��HNO2�ĵ���ƽ�ⳣ����b��>a��
����b�㵽c�㣬�����Һ��һֱ���ڣ�c(Na+)> c(NO2��) >c(OH��)> c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ô���ʯ��ĩ��3mol/L���ᷴӦ��ȡCO2���壬��Ҫ����Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ��� ����
A. ����ˮ B. ����1mol/L���� C. ���ÿ�״����ʯ D. �ʵ������¶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ������ ��
A����������������ϡ���3Fe2++4H++NO3���T3Fe3++NO��+3H2O
B����NaAlO2��Һ��ͨ�����CO2��Al��OH��3��AlO2��+CO2+2H2O�TAl��OH��3��+HCO3-
C����Ũ������MnO2��Ӧ��ȡ����������MnO2+2H++2Cl��![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
D����ǿ����Һ�д���������Fe��OH��3��Ӧ����Na2FeO4��3ClO��+2Fe��OH��3�T2FeO42��+3Cl��+H2O+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,�����������Ϊ1.0 L �ĺ����ܱ������з�����Ӧ:2A(g�� ![]() B(g��+C(g��
B(g��+C(g��
���� ��� | �¶� (���� | ��ʼ���ʵ���(mol�� | ƽ�����ʵ���(mol�� | |
A(g�� | B(g�� | C(g�� | ||
�� | 387 | 0. 20 | 0. 080 | 0. 080 |
�� | 387 | 0. 40 | ||
�� | 207 | 0. 20 | 0. 090 | 0. 090 |
����˵������ȷ������ ��
A. �÷�Ӧ������ӦΪ���ȷ�Ӧ
B. �ﵽƽ��ʱ,�������е�A����������������е���ͬ
C. �������з�Ӧ����ƽ������ʱ����������еĶ�
D. ����ʼʱ���������г���0.15 mol A��0.15 mol B��0.10 mol C��Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.NH3�����к��зǼ��Լ�
B.CCl4�����к������Ӽ�
C.H2O������ֻ�м��Լ�
D.CO2������û�м��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��ͬѧ���о�SO2��������ʡ�
��1���Ƚ��±��е��������ʹ�ϵ����2��������X�Ļ�ѧʽ�� ��
��1�� | ��2�� |
C��CO��CO2��H2CO3��Na2CO3����NaHCO3�� | S ��SO2��SO3��X��Na2SO4��NaHSO4 |
��2��������ͼװ��������SO2������
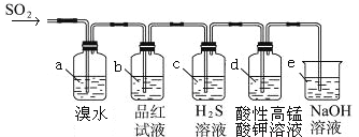
��װ��a�е������ǣ� �� ����ܡ����ܡ���˵�� SO2 ��Ư����
����װ��e����40 mL 2��5 molL��1 NaOH��Һ����Ӧ������4��8 g����װ��IV�з�����Ӧ���ܻ�ѧ����ʽ�� ��
��3����С��ļס�����λͬѧ������ͼװ�ü���̽��SO2������Ư���ԣ�
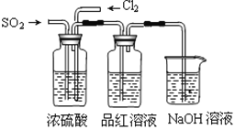
ͨ��һ��ʱ���ͬѧʵ�������Ʒ����Һ��������ɫ������ͬѧ��ʵ��������Ʒ����Һ��ʱ������Ʊ��Խ��Խdz���Ը��ݸ�ʵ��װ�ú�����ͬѧ��ʵ�����ش����⡣
���Է�����ͬѧʵ������У������ӷ���ʽ��ʾƷ����Һ����ɫ��ԭ���ǣ� ��
������Ϊ��ͬѧ������������Ʒ����Һ���Խ��Խdz�ģ�
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ���� �� ��
A������Ȼ�þ��Һ��2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
B��������������������������Һ��Ӧ��Fe(OH)3+3H+��Fe3++3H2O
C������������Һ�м���������Ba2++OH��+H++SO42����BaSO4��+H2O
D�������ǽ����������в������ݣ�CO32����2H��=CO2����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��NaNO3��Mg(NO3)2��Al(NO3)3������Һ�������Ϊ3:2:1ʱ��������Һ��c(NO3-)֮��Ϊ
A��1:1:1 B��1:2:3 C��3:2:1 D��3:4:3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com