
已知各物质的溶度积:Ksp (FeS) =6.3×10-18mol2·L-2 , Ksp (CuS) =1.3×10-36mol2·L-2
下列说法正确的是
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学试卷(解析版) 题型:选择题
下列措施可使2HBr (g) Br2 (g) +H2 (g) △H>0平衡向正反应方向移动的是( )
Br2 (g) +H2 (g) △H>0平衡向正反应方向移动的是( )
A.升温 B.加压 C.恒温恒容通入氢气 D.加入催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期12月月考化学试卷(解析版) 题型:推断题
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
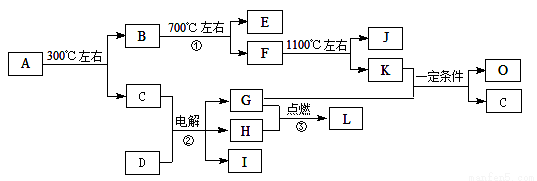
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
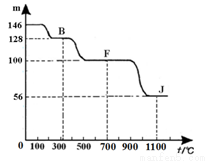
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁任城区高二上学期统考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量
B.已知C(s)+O2(g)=CO2(g) △H1;C(s)+1/2O2(g)=CO(g) △H2,则△H1﹥△H2
C.由C(s,石墨)=C(s,金刚石) △H=+73kJ/mol,可知金刚石比石墨稳定
D.据能量守恒定律,反应物的总能量一定等于生成物的总能量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市高一上12月阶段测化学试卷(解析版) 题型:选择题
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④Na2O2投入FeCl3溶液
A.①④ B.②③④ C.②③ D.①③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省平度市高一上学期直升班抽考化学试卷(解析版) 题型:选择题
下列反应中,Na2O2只表现出氧化性的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
C.Na2O2+SO2=Na2SO4
D.5Na2O2+2KMnO4+8H2SO4=SNa2SO4+K2SO4+2MnSO4+5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学情调查化学试卷(解析版) 题型:填空题
食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
弱酸 | CH3COOH | H2CO3 | HNO2 |
电离常数 | K=1.8×10-5 | K=4.3×10-7 K=5.6×10-11 | K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH-)____________;
(2)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2 溶液分别与20mL 0.10mol•L-1NaHCO3 溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH )______ v(HNO2)(填“>”、“<”或“:”),原因是____________;
②充分反应后.两溶液中c(CH3COO-)______ c(NO2-)(填“>”、“<”或“=”)。
(3)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =_____;
=_____;
(4)常温下,下列方法可以使0.1mol·L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
(5)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是________。
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质 ③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上12月月考化学试卷(解析版) 题型:选择题
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
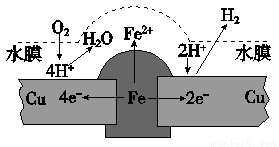
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西钦州港经济开发区中学高二上12月月考化学试卷(解析版) 题型:计算题
环保检测中,有害气体的浓度常用1 L气体中有害气体的毫克值(mg·L -1 )来表示。如对某气体样品中所含CO的浓度进行测定,其方法和实验步骤如下:
①首先将2.00 L的气体样品通过盛有I 2 O 5 固体的加热管,反应后生成CO 2 和I 2 。
②用30.0 mL 5.00×10 -3 mol·L -1 的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
I 2 +2 S2O32- 2I - + S4O62-
2I - + S4O62-
③将②中溶液取出1/5,加入1.00 mL 1.00×10 -2 mol·L -1 的碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化。
(1)写出步骤①中CO通过I 2 O 5 加热管时有关反应的化学方程式。
(2)计算样品中CO的浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com