
�����ǵ����Ϻ����ḻ��һ��Ԫ�أ��䵥�ʼ��������ڹ�ũҵ������������������Ҫ���á�
��1��һ���¶��£���1L�ݻ��㶨���ܱ������г���2mol N2��8mol H2��������Ӧ��10min��ƽ�⣬��ð�����Ũ��Ϊ0.4mol/L����ʱ������ת����Ϊ ��
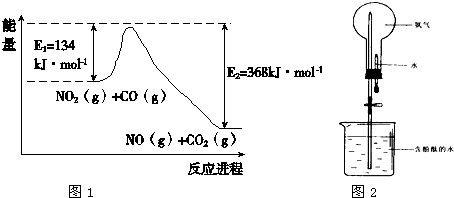
��2����ͼ��1mol NO2(g)��1mol CO(g)��Ӧ����1mol CO2(g)��1mol NO(g)�����������仯ʾ��ͼ����д���÷�Ӧ���Ȼ�ѧ����ʽ ��

��3��NH3(g)ȼ�յķ���ʽ4NH3(g)+7O2(g)==4NO2(g)+6H2O(l)��
��֪��2H2(g)+O2(g)==2H2O(l) ��H= -483.6 kJ/mol
N2(g)+2O2(g)==2NO2 (g) ��H=+67.8 kJ/mol
N2(g)+3H2(g)==2NH3 (g) ��H=-92.0 kJ/mol
�����NH3 (g)��ȼ���� ��
|
�¶�[��Դ:ѧ��ơ���] |
ƽ��Ũ��/ (mol L��1)[��Դ:ѧ*��*��Z*X*X*K][��Դ:ѧ_��_��Z_X_X_K] |
|
|
c(NH3) |
c(CO2) |
|
|
T1 |
0.1 |
|
|
T2 |
|
0.1 |
��4����һ�����İ�������粒�������ij�ݻ��㶨����������У�������Ӧ��
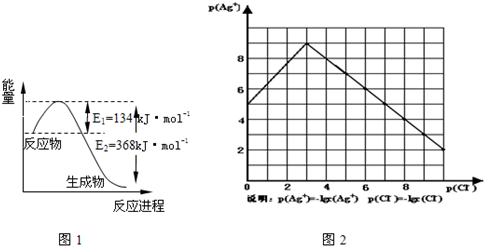
H2NCOONH4(s) 2NH3(g)+CO2(g) �ڲ�ͬ�¶��£��÷�Ӧƽ��״̬�������ݼ��ұ�������˵����ȷ����
2NH3(g)+CO2(g) �ڲ�ͬ�¶��£��÷�Ӧƽ��״̬�������ݼ��ұ�������˵����ȷ����
A����T2��T1����÷�Ӧ�Ħ�H��0
B�����������N2��H2NCOONH4��������
C��NH3�����������ʱ��˵���÷�Ӧ�ﵽƽ��
D��T1��T2ʱ��H2NCOONH4ת���Ħ�n(T2)=2��n(T1)
����ˮ��Դ�����þ��й���ǰ������ˮ����Ҫ���ӵĺ������£�
|
�ɷ� |
����/(mg L��1) |
�ɷ� |
����/(mg L��1) |
|
Cl�� |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3�� |
142 |
|
SO42�� |
2560 |
Br�� |
64 |
|
Mg2+ |
1272 |
|
|
 ��������������ˮʾ��ͼ����ͼ��ʾ�����������������ӽ���Ĥ������������������ͨ����
��������������ˮʾ��ͼ����ͼ��ʾ�����������������ӽ���Ĥ������������������ͨ����
��1��������Ҫ�缫��Ӧʽ�� ��
��2����������������������ɫ��������ɷ��� ��CaCO3������CaCO3�����ӷ���
ʽ�� ��

��3����ˮ�ij���Ϊ ���a������b����c������
��1�� 10% ��1�֣�
��2�� NO2(g) + CO(g) = NO(g) + CO2(g) ��H = -234KJ/mol��2�֣�
��3�� 282.8kJ/mol��2�֣� ��4��D��2�֣�
��1����1�֣�2Cl��-2e��=Cl2��
��2����2�֣�Mg(OH)2��Ca2++ OH��+HCO3��=CaCO3��+H2O ��2�֣� ��3��b��2�֣�
����������1�����ɰ���0.4mol����Ҫ����0.2mol����ת������10����
��2����ͼ��֪��Ӧ���ȣ��ų���������368kJ/mol��134 kJ/mol��234 kJ/mol���������Ȼ�ѧ����ʽΪNO2(g) + CO(g) = NO(g) + CO2(g) ��H = -234KJ/mol��
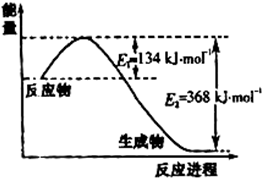
��3�������˹���ɵ�Ӧ�á�����֪��3����Ӧ�ֱ���Ϊ�٢ڢۣ���١�3���ۡ�2���ڡ�2���õ�4NH3(g)+7O2(g)==4NO2(g)+6H2O(l)������H����1131.2 KJ/mol����������ȼ������282.8kJ/mol��
��1���ڵ���������ʧȥ���ӣ��������������ӿ�֪�������������ӷŵ磬2Cl��-2e��=Cl2����
��2��������ˮ������������ӷŵ磬���������ӷŵ磬�ƻ���������Χˮ�ĵ���ʹOH��Ũ���������������������þ������ΪOH����HCO3���������CO32������������̼��ơ�
��3������װ�õ��ص�ɿ�����ˮ�е�����ͨ������Ĥ�������ƶ�����ˮ���м��������b�ڳ���ˮ��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| T/K | 298 | 398 |
| ƽ�ⳣ��K | K1 | K2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| ���� |
| ���¸�ѹ |
| ���� ��� |
��ʼʱ�����ʵ����ʵ���/mol | ��Ӧ��ƽ��ʱ���ʱ�/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | ��H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | ��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| t/�� | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| T/K | 298 | 398 | 498 |
| K | 4.1��106 | K1 | K2 |

| O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش�| t/K | 298 | 398 | 498 | �� |
| K/��mol?L-1��2 | 4.1��106 | K1 | K2 | �� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com