
| A. | (CN)2+H2O?HCN+HCNO | |
| B. | (SCN)2+2Cu$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuSCN | |
| C. | (OCN)2+2NaOH═NaOCN+NaOCNO+H2O | |
| D. | MnO2+4HSCN(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ (SCN)2↑+Mn(SCN)2+2H2O |
分析 根据题意“(CN)2、(SCN)2、(OCN)2与卤素单质的性质相似”,可以用替代法来判断,可知类卤素能与水、金属、氢气反应,由“2Fe+3(SCN)2=2Fe(SCN)3”,2Fe+3Cl2═2FeCl3,可知类卤素具有较强的氧化性,与金属反应生成最高价态的化合物,据此分析.
解答 解:A.卤素单质能与水反应,(CN)2与卤素单质的性质相似,则与水反应,发生(CN)2+H2O=HCN+HCNO,故A正确;
B.由“2Fe+3(SCN)2=2Fe(SCN)3”,可知类卤素具有较强的氧化性,与金属反应生成最高价态的化合物,(SCN)2与Cu在加热条件下反应为(SCN)2+Cu$\frac{\underline{\;\;△\;\;}}{\;}$Cu(SCN)2,故B错误;
C.(OCN)2+2NaOH=NaOCN+NaOCNO+H2O 和Cl2+2NaOH=NaCl+NaClO+H2O反应类似,可以用Cl替代OCN与后一个反应对比,故C正确;
D.MnO2与浓盐酸反应生成氯气,(CN)2与卤素单质的性质相似,则HCN与MnO2反应生成(CN)2,反应的方程式为MnO2+4HCN$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O,故D正确;
故选B.
点评 本题考查类卤素知识,题目难度中等,注意把握题中信息,特别是“2Fe+3(SCN)2=2Fe(SCN)3”,可知类卤素具有较强的氧化性.


科目:高中化学 来源: 题型:选择题
| A. | 激素类药物乙烯雌酚的结构简式为: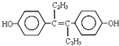 ,它的分子式是:C18H22O2 ,它的分子式是:C18H22O2 | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 实验证实 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键 | |
| D. | 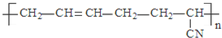 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强 | |
| B. | Na、Mg、Al三种元素的原子半径依次减小 | |
| C. | F、Cl、Br三种原子的核外电子层数依次增多 | |
| D. | 、N、O、F三种元素的非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
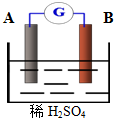 如图为原电池装置:
如图为原电池装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO42-、NO3- | B. | Al3+、Na+、HCO-3、Cl- | ||
| C. | Fe3+、K+、Cl-、SCN- | D. | K+、SO2-4,Na+、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
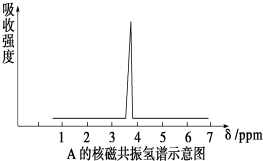
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁是活泼金属,铁器不能盛装所有酸 | |
| B. | 硫酸铁具有氧化性,它可用于自来水净化和消毒 | |
| C. | 铁具有延展性,可以用铁丝替代铝材料作导线 | |
| D. | 铁红常用于制作红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com