
【题目】碳元素是形成单质及其化合物种类最多的元素。回答下列问题:
(1)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为_________,其中C原子的杂化方式为__________,该物质易溶于水的主要原因是_______________。
(2)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为_______;CO可以和很多过渡金属形成配合物,如Ni(CO)4,写出基态Ni原子的电子排布式__________。
(3)碳的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为__________

(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有σ键的数目为________。
(5)图③为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0,1/2),C为(1/2,1/2,0);则D原子的坐标参数为__________。
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是___________g·㎝-3(列出计算式即可,阿伏加徳罗常数为NA)。
【答案】O>N>C>H sp2 CO(NH2)2分子与水分子之间能形成氢键 ![]() 1s22s22p63s23p63d84s2 KC8 90
1s22s22p63s23p63d84s2 KC8 90 ![]()
![]()
![]()
【解析】
(1)元素的非金属性越强,其电负性越大,故电负性O>N>C>H,CO(NH2)2中C原子成2个C-N键,1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,该物质易溶于水的主要原因是CO(NH2)2分子与水分子之间能形成氢键,故答案为:O>N>C>H;sp2;CO(NH2)2分子与水分子之间能形成氢键。
(2)CO与N2互为等电子体,N2的结构式为N三N ,故CO的结构式为![]() ,Ni是28号元素,基态时电子排布式1s22s22p63s23p63d84s2,故答案为:
,Ni是28号元素,基态时电子排布式1s22s22p63s23p63d84s2,故答案为:![]() ;1s22s22p63s23p63d84s2。
;1s22s22p63s23p63d84s2。
(3)根据图①所示可知如果取3个钾原子构成的三角形,则三角形中碳原子是4个,而钾原子的个数是3×1/6=1/2,因此化学式可表示为KC8,故答案为:KC8。
(4)1个C60分子中每个C形成3个C-C键,且每个键为2个C共用,则每个碳原子含有的σ键个数为1.5,所以1个C60分子中σ键的数目为1.5×60=90,故每个C60分子中含有σ键的数目为90,答案为:90。
(5)由图示可知,与D相连的4个原子形成正四面体结构,且D位于正四面体的体内。由B在x轴的坐标为1/2知,D在x轴的坐标为1/4。同理得出D在y、z轴的坐标均为1/4,则D原子的坐标参数为![]() ,故答案为:
,故答案为:![]()
(6)因为金刚石属于面心立方晶胞,即C原子处在立方体的8个顶点,6个面心,体内有4个,故根据均摊法及BN的化学式可推知,一个晶胞中各含有4个B原子、4个N原子,又因为一个BN的质量是M/NA,而一个晶胞的体积是(361.5×10-10)3cm3,故密度=质量÷体积=![]() g·cm-3,故答案为
g·cm-3,故答案为![]() 。
。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2。下列分析不正确的是

A. 推测青蒿素在乙醚中的溶解度小于在水中的溶解度
B. 通过元素分析与质谱法可确认青蒿素的分子式
C. 青蒿素中含有的 “![]() ” 基团是酯基
” 基团是酯基
D. 青蒿素中对热不稳定且具有氧化性的基团是“—O—O—”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2Na2O2+2H2O = 4NaOH+O2↑中化学键的变化判断正确的是
A.只有离子键的断裂和形成
B.只有共价键的断裂和形成
C.既有离子键和共价键的断裂,又有离子键和共价键的形成
D.既有离子键和极性键的断裂,又有离子键和极性键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的两种方法。回答下列问题:
I.直接法

(1)气体X 为_______(填化学式)。
(2)写出“转化”步骤发生反应的离子方程式_________。
(3)滤液①中加入甲醇的作用是_____________。
(4)操作I 为__________。
II.电解法
电解法制取KH2PO4 的原理如图所示,一定条件下,还可得到NaClO3

(5)在_____室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式_____________。
III.纯度分析
测定产品纯度的反应原理为KH2PO4+NaOH=KNaHPO4+H2O
(6)取产品3.00 g,加入15 mL 蒸馏水溶解,加入指示剂,用0.5000 mol·L-1 NaOH 标准溶液滴定至终点,消耗40.00 mL,该产品的纯度为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国首架按照国际标准研制,拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2,其反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
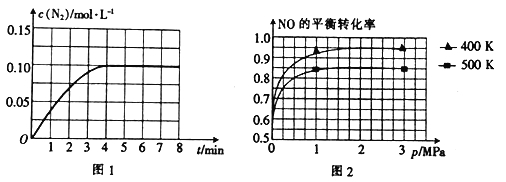
(2)若将1 molNO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=_________,4 min末CO的浓度为_____________ molL-1。
(3)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置比较适合的温度和压强是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2 与Na2O2 反应的探究实验,回答下列问题。
(1)用下图装置制备纯净的CO2

①丙装置的名称是__________,乙、丙装置中盛装的试剂分别是__________、_________。
②若CO2 中混有HCl,则HCl 与Na2O2 反应的化学方程式为_____________。
(2)按照下面的装置图进行实验(夹持装置略)。

①先组装仪器,然后_____________,再用注射器1 抽取100 mL 纯净的CO2,将其连接在K1 处,注射器2 的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1 的活塞,可观察到的现象是_________。
③实验过程中,需缓慢推入CO2,其目的是_____________,为达到相同目的,还可进行的操作是_____________。
(3)实验结束后,当注射器1 的活塞推到底时,测得注射器2 中气体体积为65 mL,则CO2的转化率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用的原理(用化学方程式表示)及基本反应类型均正确的是
A. 用赤铁矿高炉炼铁:Fe2O3 + 3CO![]() 2Fe+3CO2 置换反应
2Fe+3CO2 置换反应
B. 加热混有二氧化锰的氯酸钾制取氧气:2KClO3![]() 2KCl+3O2↑ 分解反应
2KCl+3O2↑ 分解反应
C. 硫酸厂污水可用熟石灰中和处理:H2SO4 + Ca(OH)2=CaSO4+ H2O 复分解反应
D. 用红磷气中氧气含量:2P +5O2![]() 2P2O5 氧化反应
2P2O5 氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪是一种多巴胺受体的阻断剂,临床有多种用途。化合物Ⅲ是盐酸氯丙嗪制备的原料,可由化合物I和Ⅱ在铜作催化剂条件下反应制得。

(1) Cu基态核外电子排布式为________________。
(2) 1 mol化合物Ⅰ分子中含有σ键数目为________。
(3) 化合物Ⅲ分子中sp3方式杂化的原子数目是____________。
(4) 向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该白色沉淀中Cu、S、N的物质的量之比为1∶1∶1,沉淀中有一种三角锥形的阴离子和一种正四面体形的阳离子。
①[Cu(NH3)4]SO4中存在的化学键类型有________(填字母)。
A. 共价键 B. 氢键 C. 离子键 D. 配位键 E. 分子间作用力
② 上述白色沉淀的化学式为____________________________。
(5) 铜的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式:__________________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com