
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)??? ?  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)???  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)???  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为? ???????????? ? 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
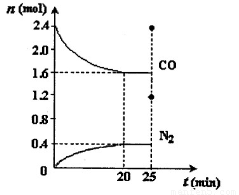
①NO的平衡转化率为??? ,0~20min平均反应速率v(NO)为 ??????????? 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将????????? 移动(填“向左”、“向右”或“不”)。
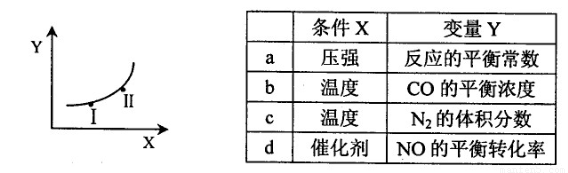
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是?? ?? (填字母代号)。
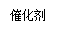
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为? ????????????? ? 。假设电解质溶液的体积不变,下列说法正确的是????? ??? (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02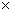 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
(1)4NH3(g)+5O2(g) 4NO(g) +6H2O(g)? ΔH=﹣905kJ·mol-1(3分)
4NO(g) +6H2O(g)? ΔH=﹣905kJ·mol-1(3分)
(2)① 28.6%(2分)? 0.02 mol·L-1·min-1(2分)? 向左(2分)
② b(3分)
(3) N2+8H++6e-=2NH4+ (3分)Bcd(3分)
【解析】
试题分析:(1)先写出NH3与O2反应的化学方程式,并注明物质的状态,然后根据盖斯定律求算?H,?H=2×?H1+3×?H2—2×?H3=﹣905kJ·mol-1,可得热化学方程式:4NH3(g)+5O2(g) 4NO(g) +6H2O(g)? ΔH=﹣905kJ·mol-1。
4NO(g) +6H2O(g)? ΔH=﹣905kJ·mol-1。
(2)①根据三段式进行计算,2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
???? 起始浓度(mol?L?1)??? 1.4???? 1.2?????? 0????? 0
???? 转化浓度(mol?L?1)??? 0.4???? 0.4?????? 0.2??? 0.4
???? 平衡浓度(mol?L?1)??? 1.0???? 0.8?????? 0.2??? 0.4
则NO的转化率为:0.4mol/L÷1.4mol/L×100%=28.6%;0~20min平均反应速率v(NO)=0.4mol/L÷20min= 0.02 mol·L-1·min-1;根据平衡浓度可求出平衡常数K=0.2×0.42÷(12×0.82)=0.05,加入CO、N2后Q=0.6×0.42÷(12×1.22)=0.22,因为Q>K,所以平衡向左移动。
②a、压强增大,化学平衡常数不变,不符合图像,错误;b、因为该反应为放热反应,温度升高,平衡向左移动,所以CO浓度增大,符合图像,正确;c、因为该反应为放热反应,温度升高,平衡向左移动,所以N2的体积分数减小,不符合图像,错误;d、催化剂不影响化学平衡,NO的平衡转化率不变,不符合图像,错误。
(3)N2的氧化性大于H2,所以正极上N2得电子,根据化合价的变化可得电解方程式:N2+8H++6e-=2NH4+ ;a、该燃料电池的总反应为:N2+3H2+2H+=2NH4+,消耗了H+,所以pH增大,错误;b、根据电池反应,生成了NH4+,所以溶液中的NH4Cl浓度增大,但Cl-离子浓度不变,正确;c、H2被氧化,电子转移为:H2 ~ 2e?,所以每转移6.02 1023个电子,则有标准状况下11.2L电极反应物被氧化,正确;d、随着电池反应的进行,NH4+的浓度越大,所以为保持放电效果,电池使用一段时间需更换电解质溶液,正确。
1023个电子,则有标准状况下11.2L电极反应物被氧化,正确;d、随着电池反应的进行,NH4+的浓度越大,所以为保持放电效果,电池使用一段时间需更换电解质溶液,正确。
考点:本题考查热化学方程式的书写、转化率和平衡的计算、图像的分析、原电池的原理。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对含硫化石燃料进行脱硫处理 | B、研发和使用替代化石燃料的新能源 | C、对含SO2废气进行回收和利用 | D、将含SO2废气直接排放至高空 |
查看答案和解析>>
科目:高中化学 来源: 题型:
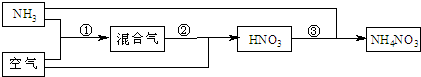
①P+A→Q+B ②L+O2→M+H2O ③L+M→R+H2O ④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_________,理由是_________________________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为__________。
(3)某学生写出下面三个含氮物质的相互转化的关系式:
(a)M+P→N2O3+H2O (b)N2O4+H2O→P+Q (c)M+L→Q+H2O
其中一定不可能实现的是____________,理由是_________________________________。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com