
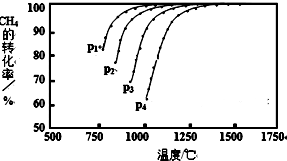
分析 温度一定条件下,增大压强平衡逆向移动,CH4的平衡转化率减小;
由图可知,压强一定时,升高温度,甲烷的转化率增大,说明升高温度平衡正向移动;
1000℃甲烷的转化率为80%,则转化的甲烷为5mol×80%=4mol,则:
CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始量(mol):5 5 0 0
变化量(mol):4 4 8 8
平衡量(mol):1 1 8 8
再根据K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$计算平衡常数.
解答 解:温度一定条件下,增大压强平衡逆向移动,CH4的平衡转化率减小,故压强p4>p3>p2>p1;
由图可知,压强一定时,升高温度,甲烷的转化率增大,说明升高温度平衡正向移动,而升高温度平衡向吸热反应方向移动,故正反应为吸热反应;
1000℃甲烷的转化率为80%,则转化的甲烷为5mol×80%=4mol,则:
CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始量(mol):5 5 0 0
变化量(mol):4 4 8 8
平衡量(mol):1 1 8 8
容器容积为2L,则平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}$=$\frac{(\frac{8mol}{2L})^{2}×(\frac{8mol}{2L})^{2}}{\frac{1mol}{2L}×\frac{1mol}{2L}}$=1024 mol2•L-2,
故答案为:p4>p3>p2>p1;吸热;1024 mol2•L-2.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、平衡常数等,注意化学平衡常数及单位与化学计量数有关.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ | B. | I- | C. | SO$\stackrel{2-}{4}$ | D. | CO$\stackrel{2-}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠质软,可用小刀切割 | |
| B. | 钠要保存在煤油或者石蜡油中 | |
| C. | 钠着火可用干沙扑灭 | |
| D. | 钠与氧气反应,产物是由氧气的量决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子数等于族序数 | |
| B. | 主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8 | |
| C. | 分子结构相似的分子相对分子质量越大熔沸点越高 | |
| D. | 元素的原子得电子越多非金属性越强,失电子越多,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| B. | PM2.5表面积大,能吸附大量的有毒、有害物质 | |
| C. | 高纯硅在太阳能电池及信息高速传输中有重要应用 | |
| D. | 从海水中提取物质不一定要通过化学反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb2++2CH3COO-+2H++S2-═PbS↓+2CH3COOH | |
| B. | Pb2++H2S═PbS↓+2H+ | |
| C. | Pb2++2CH3COO-+H2S═PbS↓+2CH3COOH | |
| D. | (CH3COO)2Pb+H2S═PbS↓+2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
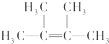 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.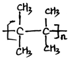 .
.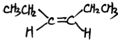 或(CH3CH2)2C=CH2.
或(CH3CH2)2C=CH2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com