
| A. | 溶液中c(H+)=1.0×10-2 mol•L-1 | |
| B. | 此溶液中由水电离出的c(OH-)=1.0×10-12 mol•L-1 | |
| C. | 加水稀释100倍后,溶液的pH=4 | |
| D. | 加入等体积pH=12的氨水,溶液呈中性 |
分析 A、pH=2的溶液中c(H+)=10-2mol/L;
B、在酸溶液中,氢氧根全部来自于水的电离,且水电离出的c(H+)=c(OH-);
C、将pH=a的强酸加水稀释至原来的10b倍,则pH=a+b(a+b<7);
D、一水合氨是弱电解质,在溶液中部分电离.
解答 解:A、pH=2的溶液中c(H+)=10-2mol/L,与溶液的温度无关,故A正确;
B、在酸溶液中,氢氧根全部来自于水的电离,故常温下的pH=2的盐酸溶液中c(OH-)=10-12mol/L,全部来自于水的电离,即此溶液中水电离出的c(OH-)=10-12mol/L,故B正确;
C、将pH=a的强酸加水稀释至原来的10b倍,则pH=a+b(a+b<7),故将pH=2的盐酸溶液加水稀释100倍后,溶液的pH=4,故C正确;
D、一水合氨是弱电解质,在溶液中部分电离,故向盐酸中加入等体积pH=12的氨水后,氨水过量,溶液显碱性,故D错误.
故选D.
点评 本题考查了溶液pH的计算,明确强弱电解质电离特点是解本题关键,注意电荷守恒在解题中的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、OH-、S2-、NO3-不能大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO-+2H+→Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中可采用蒸馏法 | |
| B. | ②中可通过电解饱和氯化镁溶液制金属镁 | |
| C. | ③中提溴涉及到氧化还原反应 | |
| D. | ④的产品可生产盐酸、漂白液等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
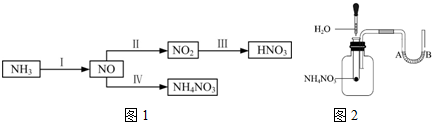
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
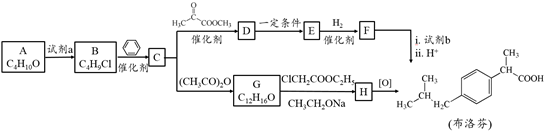

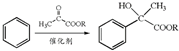
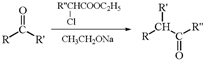
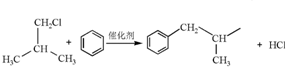 .
.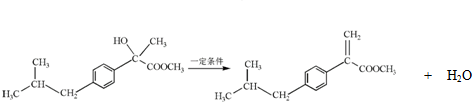 .
. ,H的含氧官能团的名称是醛基.
,H的含氧官能团的名称是醛基.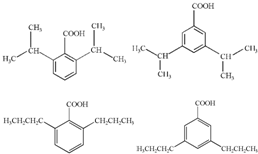 (其中两种).
(其中两种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 相关 信息 | 有两种常见的单 质,均有氧化性 | 短周期中原子半 径最大的元素 | 地壳中含量最多 的金属元素 | 最外层电子数是 电子层数的二倍 |
| A. | Y的单质燃烧火焰呈黄色 | |
| B. | 4种元素的简单离子半径最小的是Z | |
| C. | X与Y形成的化合物只含有离子键 | |
| D. | Y、Z、W的最高价氧化物对应的水化物两两之间均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 钠块投入水中,迅速熔成银白色小球 | 钠的密度比水小 |
| D | 某溶液中加入NaOH溶液,加热,产生使湿润红色石蕊试纸变蓝的气体 | 原溶液中含NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法鉴别羊毛线和棉线 | |
| B. | 分馏石油时,温度计的水银球必须插入液面下 | |
| C. | 做银镜反应实验后,试管壁上的银镜用硝酸洗涤 | |
| D. | 沾附在试管内壁上的油脂,用热碱液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com