
【题目】在实验室中新制氯水最好保存在( )
A.橡胶塞无色试剂瓶
B.橡胶塞棕色试剂瓶
C.玻璃塞无色试剂瓶
D.玻璃塞棕色试剂瓶
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 1molNa2O2与足量潮湿的CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=5的CO2溶液中,由水电离出的H+的数目为1×10-5NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,容器内分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖的一半奖金授予瑞士科学家库尔特·维特里希,以表彰他“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法。”质子核磁共振谱(简称为PMR)谱线是研究有机化合物分子结构的重要手段和依据。有机化合物分子结构中的不同环境的氢原子在PMR谱线上都有相应的峰(即谱线中的位置)。峰的强度与结构中的该氢原子的个数成正比。因此PMR谱可同时定性和定量地分析结构中氢原子的位置。如乙醛的结构式为CH3CHO,其PMR谱线有两个峰,强度之比为3︰1。
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构式可能为:________________________________________________;
(2)测定CH3CH=CHCl 时,能得到氢原子给出的信号峰共6种。由此可推断该有机物一定存在_______种不同的结构,其结构式为:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳纤维质轻、耐高温、有很高的抗拉强度与弹性,它与树脂、金属或陶瓷基体形成的复合材料广泛运用于航天飞机、火箭、导弹的外壳以及体育器具等。碳纤维的合成方法一般经历以下过程:
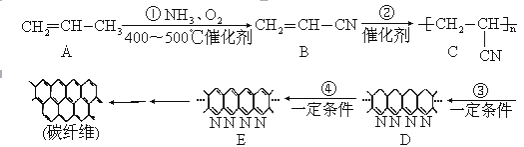
请回答下列问题:
(1)反应①的化学方程式:________________________________________________。
(2)反应②属于__________;反应④属于____________。(请选a、b、c、d填空)
a.加聚反应 b.缩聚反应 c.氧化反应 d.还原反应
(3)在化合物A、B、C、D、E中,所有原子可能在同一平面上的是____________。
(4)化合物E中碳元素的质量分数接近于________%。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
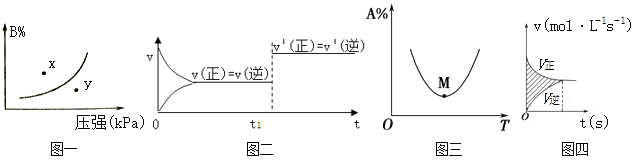
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”);298K时,将10mL pH=3的亚硝酸溶液与10mL pH=11氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”)。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是_______(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是__________。
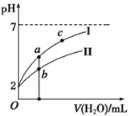
(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为___________________。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法可以加快铁和稀硫酸的反应速率的是
A. 加入少量ZnCl2固体 B. 加入少量CuSO4固体
C. 加入少量水 D. 用98%的浓硫酸代替稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)通过火法冶金炼出的铜是粗铜,含杂质多,必须进行电解精炼。请在下面方框中画出电解精炼铜的装置______。

(2)水解反应在生产生活中有很多应用。有些盐水解程度很大,可以用于无机化合物的制备,如可以用TiCl4与H2O反应,生成TiO2·xH2O,制备时加入大量的水,同时加热。请结合化学用语和必要的文字解释“加热”的作用:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com