
(1)该稀盐酸的物质的量浓度。
(2)Na2SiO3溶液的质量分数 。
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
查看答案和解析>>
科目:高中化学 来源: 题型:
1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+ 4H2(g) Na2S(s) + 4H2O(g)。
(1)该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
(2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(3)能说明该反应已达到平衡状态的是______(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2) = c(H2O) d.υ正(H2) =υ逆(H2O)
(4)向平衡体系中加入焦炭,下列图像正确的是___________(填序号)。
(5)用有关离子方程式说明上述反应产物水溶液的酸碱性______________________________,欲使该溶液中S2—浓度增大,平衡逆向移动,可加入的物质是____________________。
查看答案和解析>>
科目:高中化学 来源:2010年上海市虹口区高三第二次模拟考试化学试题 题型:填空题
1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 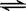 Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
(1)该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。 (2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(3)能说明该反应已达到平衡状态的是______(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2) = c(H2O) d.υ正(H2) =υ逆(H2O)
(4)向平衡体系中加入焦炭,下列图像正确的是___________(填序号)。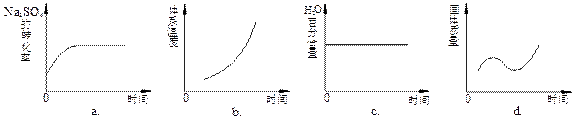
(5)用有关离子方程式说明上述反应产物水溶液的酸碱性______________________________,欲使该溶液中S2—浓度增大,平衡逆向移动,可加入的物质是____________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北衡水中学高三上学期期中考试化学试卷(解析版) 题型:填空题
许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。

已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 • 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264
mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。
查看答案和解析>>
科目:高中化学 来源:2013届度黑龙江大庆实验中学高二上学期期末考试化学试卷 题型:填空题
(8分)水的电离平衡曲线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com