
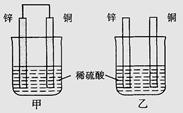
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.甲、乙溶液均变蓝 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.Fe +2HCl =" Fe" Cl2+ H2 |
| B.NaOH +HCl="NaCl+" H2O |
| C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4 |
| D.Ca CO3+2HCl=" Ca" Cl2+ H2O+ CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2在正极发生氧化反应 | B.供电时的总反应为:2H2+O2=2H2O |
| C.氢氧燃料电池是把电能转化为化学能 | D.燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
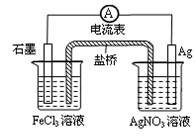
| A.导线上电子由Ag极流向石墨极 |
| B.负极电极反应式:Fe3+ + e-=Fe2+ |
| C.盐桥中阴离子移向AgNO3溶液 |
| D.总反应为:Fe3+ + Ag=Fe2+ + Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水果原电池产生电流时,发生的是氧化还原反应 |
| B.电池中失去电子的电极为阴极 |
| C.两个电极的材料可以相同 |
| D.水果电池工作时氧化反应和还原反应在同一处进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c>d | B.a>c>d>b |
| C.c>a>b>d | D.b>d>c>a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验后的记录: ①Zn极发生还原反应,Cu极发生氧化反应 ②H+向负极移动 ③电子流动方向Zn→导线→Cu ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol。 ⑥正极的电极反应式:Zn-2e- =Zn2+ |
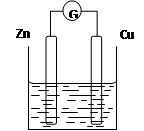
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com