
| 物质 | 密度(g/ml-3) | 沸点(℃) | 水溶性 | 溶解性 |
| 甲 | 0.7893 | 78.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
| A. | 分液 | B. | 蒸馏 | C. | 干馏 | D. | 萃取 |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
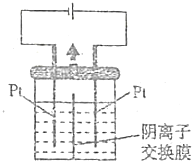 以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )
以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )| A. | 电解过程中左侧发生的电极反应式:40H--4e-═2H2O+O2↑ | |
| B. | 电解过程中左侧溶液中的0H-通过离子交换膜向右侧溶液移动 | |
| C. | 电解一段时间后左、右两侧溶液中的K+的物质的量浓度不变 | |
| D. | 电解初期,右侧溶液能变蓝色,继续电解,溶液的蓝色一定加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯:加溴水分液 | |
| B. | 乙醇中的水:加新制CaO蒸馏 | |
| C. | 甲烷中的乙烯:用溴的四氯化碳溶液洗气 | |
| D. | 乙酸乙酯中的乙酸:加饱和Na2CO3溶液分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去水垢:${CO}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用惰性电解电解氯化镁溶液:Mg2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3- | |
| D. | 碳酸氢钠溶液显碱性:${HCO}_{3}^{-}$+H2O?H2CO3+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com