
【题目】(1)在与外界隔离的体系中,自发过程将导致体系的熵 ,(填“增大”、“减小”、“不变”);对于同一种物质, 时熵值最大。(填“固态”、“液态”、“气态”)
(2)某工厂实验室用CO和H2制备CH3OH,其原理为:CO(g)+2H2(g) ![]() CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
(3)M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N________(填稳定、不稳定)
(4)一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后, 保持压强不变,充入Ar,其正反应速率__________(A.变快 B.不变 C变慢,填字母代号);该反应向__________(填正移、逆移或不移)。
【答案】(1)增大(1分),气态(1分)
(2)c(CH3OH)/c(CO)·c2(H2) >
(3)稳定(2分) (4)C,不移(2分)
【解析】
试题分析:(1)在与外界隔离的体系中,自发过程将导致体系的熵增大;对于同一种物质,气态时熵值最大。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据CO(g)+2H2(g)![]() CH3OH(g)可知该温度下的化学平衡常数表达式K=c(CH3OH)/c(CO)·c2(H2);正反应是放热反应,因此升高温度平衡向逆反应方向进行,平衡常数减小,所若在298K、398K时化学平衡常数分别为K1、K2,则K1>K2;
CH3OH(g)可知该温度下的化学平衡常数表达式K=c(CH3OH)/c(CO)·c2(H2);正反应是放热反应,因此升高温度平衡向逆反应方向进行,平衡常数减小,所若在298K、398K时化学平衡常数分别为K1、K2,则K1>K2;
(3)M与N是同素异形体,由M=N △H=+119kJ/mol可知,M的总能量低于N,能量越低越稳定,所以M比N稳定;
(4)一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后, 保持压强不变,充入Ar,则容积必然增大,浓度减小,所以正反应速变慢,答案选C;反应前后体积不变,因此平衡不移。


科目:高中化学 来源: 题型:
【题目】将2mol A和2molB充入到绝热恒容密闭容器中,发生如下反应:2A(g)+B(g)![]() 3C(g)+D(s),达到平衡测得容器内压强增大,若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是
3C(g)+D(s),达到平衡测得容器内压强增大,若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,分离出少量D,A的转化率提高
C.平衡时,升高温度,容器内混合气体的密度减小
D.平衡时,充入C,该反应平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是( )
A. 过氧化钠可用作潜艇里氧气的来源 B. 金属钠用于生产玻璃
C. 乙醇可用作燃料 D. 用漂白粉对H7N9禽流感疫区进行环境消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内所含微量元素是指总含量不到万分之一,而质量总和不到人体质量千分之一的20多种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素肯定不属于人体微量元素的是( )
A.I B.O C.Fe D.Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO-2+4NH+ 4+2H2O
C.向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO-3+2OH-=CaCO3↓+CO2-3+H2O
D.亚硫酸钠溶液滴加到酸性高锰酸钾溶液中:5SO2-3+6H++2MnO![]() =5SO2-4+2Mn2+ +3H2O
=5SO2-4+2Mn2+ +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 炼铁需要用到石灰石 B. 钠钾合金可用作核反应堆热交换剂
C. 工业上可用铁质容器存放浓硫酸 D. 用超纯硅制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图1为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
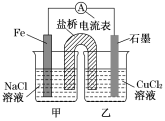
(2)如图,其他条件不变,若将乙烧杯中的CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应方程式为_____________________
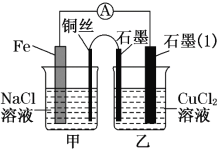
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如下图所示乙装置中与铜丝相连的石墨电极上发生的反应方程式为_____________________
Ⅱ、氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油等燃料相比,氢气作为燃料的两个明显的优点是________________(写两点)
(2)化工生产的副产品也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气。总反应方程式为:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
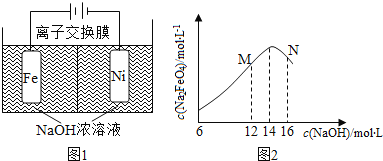
①电解一段时间后,c(OH)降低的区域在________________(填“阴极室”或“阳极室”)
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com