
| A�� | ��֪2C��s��+O2��g���T2CO��g����H=-221 kJ•mol-1����C��̼����ȼ����Ϊ110.5 kJ•mol-1 | |
| B�� | ��֪����ȼ���ȡ�H=-285.5 kJ•mol-1����2H2O��l��=2H2��g��+O2��g����H=+285.5 kJ•mol-1 | |
| C�� | ��֪�к��ȡ�H=-57.3 kJ•mol-1��������0.5 mol H2SO4��ϡ��Һ��1 mol NaOH�����ϣ��ų�������С��57.3 kJ | |
| D�� | ��20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�����28.7 kJ����ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��NaOH��aq��+CH3COOH��aq���TCH3COONa��aq��+H2O��l����H��-57.4 kJ•mol-1 |
���� A��ȼ����ָ����1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų�������������Ҫ�㣺�ٿ�ȼ�����Ϊ1mol���ڱ��������ȶ����������C��CO2��H��H2O��Һ����
B��ȼ����ָ����1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų������������淴Ӧ�ʱ���ֵ��ͬ�������෴��
C���к���ָ������ϡ��Һ�У�ǿ���ǿ�Ӧ����1molˮʱ�ų���������ע��NaOH�����ܽ�Ҫ���ȣ�
D���к���ָ������ϡ��Һ�У�ǿ���ǿ�Ӧ����1molˮʱ�ų���������ע��������ʵĵ���Ҫ���ȣ�
��� �⣺A��ȼ����ָ����1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų�������������Ҫ�㣺������ȫȼ�������ȶ����������C��CO2��H��H2O��Һ������2C��s��+O2��g��=2CO��g����H=-221 kJ•mol-1����̼�IJ���ȫȼ�գ���A����
B��ȼ����ָ����1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų�������������Ҫ�㣺��ȼ�����Ϊ1mol����֪����ȼ���ȡ�H=-285.5 kJ•mol-1����2H2��g��+O2��g��=2H2O��l����H=-285.5��2kJ•mol-1 =-571.0kJ•mol-1 ����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O��l��=2H2��g��+O2��g����H=+571.0 kJ•mol-1����B����
C����ΪNaOH�����ܽ�Ҫ���ȣ����Խ���0.5 mol H2SO4��ϡ��Һ��1 mol NaOH�����ϣ��ų�����������57.3 kJ����C����
D���к���ָ������ϡ��Һ�У�ǿ���ǿ�Ӧ����1molˮʱ�ų�����������20.0g NaOH��ϡ��Һ��ϡ������ȫ�к�����0.5molˮʱ���ų�28.7kJ�����������к��ȵ���ֵΪ57.4kJ/mol����ϡ����Ϊ���ᣬ�������ȣ���ϡ�����ϡNaOH��Һ��Ӧ���к���ӦС��57.4kJ/mol������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��NaOH��aq��+CH3COOH��aq���TCH3COONa��aq��+H2O��l����H��-57.4 kJ•mol-1����D��ȷ��
��ѡD��
���� ���⿼����ȼ���ȡ��к��ȸ���ķ����жϣ���Ӧ�ȵļ��㣬�Ȼ�ѧ����ʽ����д����Ŀ�ϼ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ܶȻ������ܽ�ƽ��ʱ���ܵ��������Һ�еĸ�����Ũ�ȵij˻� | |
| B�� | �ܶȻ������Dz����κ�����Ӱ��ij���������ܶȻ� | |
| C�� | �������ӻ�Qc���ܶȻ�Ksp�ıȽ����жϳ����ܽ�ƽ����еķ��� | |
| D�� | �������ʵ��ܶȻ��������¶ȵ����߶������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ���� | C�� | С�մ� | D�� | �ƾ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ᴿ | B�� | ������ˮ����Ϊ����ˮ | ||
| C�� | ����̿ʹ��īˮ��ɫ | D�� | ���Ȼ�̼��ȡ��ˮ�еĵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
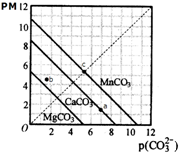
| A�� | a��ɱ�ʾCaCO3�ı�����Һ����c��Ca2+����c��CO32-�� | |
| B�� | b��ɱ�ʾMgCO3�IJ�������Һ����c��Mg2+����c��CO32-�� | |
| C�� | c�ɱ�ʾMnCO3�ı�����Һ����c��Mn2+��=c��CO32-�� | |
| D�� | MgCO3��CaCO3��MnCO3��Ksp�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
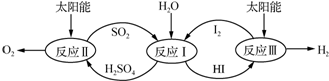
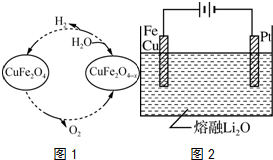
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
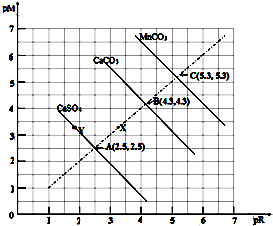
| A�� | MnCO3�ڳ����µ�Ksp=2.5 x10-11����֪100.4=2.5�� | |
| B�� | ���������ڳ����µ��ܽ�ȴ�С˳��ΪMnCO3��CaCO3��CaSO4 | |
| C�� | ����Y���CaSO4��Һ��c��Ca2+����c��SO42-�� | |
| D�� | Ca2+��CO32-Ũ��ΪX�����Һ��ͨ�������ܼ���ΪB�����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com