
分析 (1)氯化铵溶液中氢离子就是水电离出的,盐酸溶液中水电离出的c(H+)等于溶液中c(OH-);
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,可能为氯化铵溶液或氯化铵、氨水或氯化铵、盐酸混合物;任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等;任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;根据电荷守恒判断溶液的酸碱性;
(3)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7;
(4)电离度越大,相同PH溶液的浓度越小,所以相同PH的醋酸和亚硫酸溶液的物质的量浓度:CH3COOH>H2SO3,盐对应的酸越弱水解程度越大PH越大;
(5)至铝离子刚好沉淀完全时,以2:3反应,生成硫酸钡和氢氧化铝、硫酸钾.
解答 解:(1)化铵溶液中氢离子就是水电离出的,则氯化铵溶液中由水电离出的c(H+)=10-3 mol•L-1,盐酸溶液中水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11 mol•L-1,所以由水电离出的c(H+)之比为1:108,故答案为:1:108;
(2)任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等,这几个选项中只有②中阴离子电荷之和大于阳离子电荷之和,与水溶液呈电中性相违背,故②一定不正确;因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-);若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒知c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(H+)=c(OH-),所以溶液呈中性,故答案为:②; ①;中性;
(3)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液,故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=-lg$\frac{1{0}^{-14}}{1{0}^{-p{H}_{b}}}$lg10-pHc =-lg10-14=14,故答案为:CH3COONa;盐酸;14;
(4)电离度越大,相同PH溶液的浓度越小,所以相同PH的醋酸和亚硫酸溶液的物质的量浓度:CH3COOH>H2SO3,酸性H2SO3>CH3COOH>HSO3-,所以相同浓度的醋酸钠、亚硫酸钠、亚硫酸氢钠溶液的PH由大到小的顺序为 Na2SO3>CH3COONa>NaHSO3,故答案为:>;Na2SO3>CH3COONa>NaHSO3;
(5)至铝离子刚好沉淀完全时,以2:3反应,生成硫酸钡和氢氧化铝、硫酸钾,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故答案为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓.
点评 本题考查了离子浓度大小比较、盐的水解程度和PH的相关计算,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒来分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下加入浓硫酸 | |
| D. | 上述说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
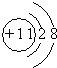 ;
; ,E离子的符号为Cl-;
,E离子的符号为Cl-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
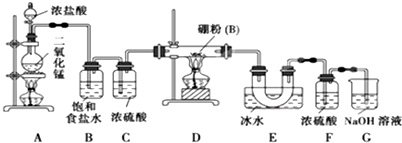
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
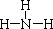 ,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.
,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取15.80g NaCl固体 | |
| B. | 用10mL量筒量取6.25 mL稀硝酸 | |
| C. | 用精密pH试纸测得某溶液的pH为4.2 | |
| D. | 做中和滴定实验时,用50mL规格的酸式滴定管去取17.90mL的烧碱溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com