
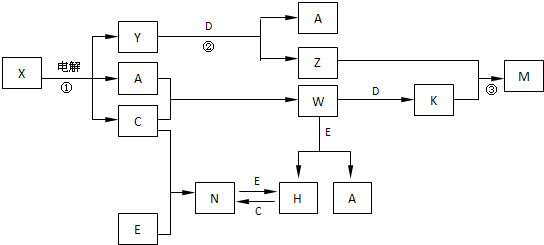
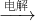 A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意; 组
组 故答案为:
故答案为: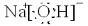
 2Fe+Al2O3;在实验室中,引发该反应的实验操作为:将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;故答案为:Fe2O3+2Al
2Fe+Al2O3;在实验室中,引发该反应的实验操作为:将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;故答案为:Fe2O3+2Al 2Fe+Al2O3;将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;
2Fe+Al2O3;将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条;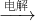 A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;
A+C+Y,可以初步推断X为NaCl溶液电解生成了H2、Cl2、NaOH;A、B、C、D、E是中学化学常见单质;X是B和C的化合产物,所以B为Na,C为Cl2;所以Y一定是NaOH;Y+D→A+Z,此反应是D单质和氢氧化钠溶液反应生成A单质,通过所学D为金属铝,A为H2,Z为NaAlO2;C为Cl2;A+C→W,W为HCl,W+D→K,K为AlCl3;Z+K→M,M为Al(OH)3;验证3(a+b)=2(a+c)=3(d-a);上述推断符合;根据转化关系,E是单质,W(HCl)+E→H+A(H2);H+C(Cl2)→N;N+E→H,说明E是变价元素单质,和酸反应证明是金属单质,所以判断E为Fe;H(FeCl2),N为(FeCl3)结合转化关系符合题意;根据判断出的物质和转化关系回答问题;

科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中,与D形成的化合物是生活中最常用的调味品 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com