

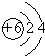 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0;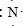 →
→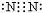 .
.分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为P、⑧为S、⑨为Cl.
(1)由元素位置可知,元素⑥处于周期表中第三周期第ⅣA族;元素非金属性越强,最高价含氧酸的酸性越强;
(2)元素②与元素⑨形成的化合物为CCl4;
(3)元素②为碳元素,原子核外有2个电子层,各层电子数为2、4;元素②的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对;
(4)氮气分子中氮原子之间形成三键,化学性质稳定,通常可以做保护气;
(5)元素非金属性越强,对应氢化物越稳定;
(6)同周期自左而右原子半径减小、同主族自上而下原子半径增大.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为P、⑧为S、⑨为Cl.
(1)由元素位置可知,元素⑥处于周期表中第三周期第ⅣA族;非金属性S>P,元素非金属性越强,最高价含氧酸的酸性越强,故H2SO4的酸性更强,故答案为:第三周期第ⅣA族;H2SO4;
(2)元素②与元素⑨形成的化合物为CCl4,属于共价化合物,故答案为:共价;
(3)元素②为碳元素,原子核外有2个电子层,各层电子数为2、4,原子结构示意图为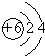 ;元素②的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
;元素②的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
故答案为: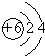 ;O=C=O;
;O=C=O;
(4)氮气分子中氮原子之间形成三键,化学性质稳定,通常可以做保护气,请用电子式表示其分子的形成过程为:2 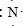 →
→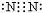 ,故答案为:2
,故答案为:2 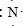 →
→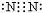 ;
;
(5)非金属性O>S>P,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(6)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Si>P>N,故答案为:Si>P>N.
点评 本题考查元素周期表与元素周期律,比较基础,侧重对元素周期律的考查,注意理解用电子式表示物质或化学键的形成.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2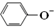 +H2O+CO2→2 +H2O+CO2→2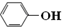 +CO32- +CO32- | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$  | |
| D. | 乙醛溶液与足量的银氨溶液共热的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| B. | 反应中I2为氧化剂,Cl2为氧化产物 | |
| C. | 生成1 mol Cl2时转移2 mol电子 | |
| D. | 由方程式可知还原性I2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
| 实验一 | 足量MnO2 | a.充分反应后未见黑色固体物质减少 b.收集到112mL气体 | ①催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | c.充分反应后黑色粉末部分溶解 d.收集到112mL气体 | ②氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
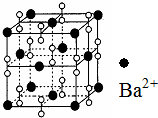 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com