

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
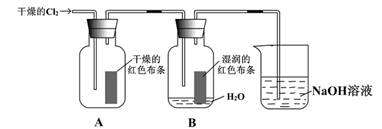
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��MgCl2 | B��ZnCl2 | C��BaCl2 | D��KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������MnO2������Cl2 | B��ͭƬ��Ũ���� |
| C������ʯ�顢���� | D���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��SO42- | B��SO32- | C��S | D��S2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ��ˮ����������Һ�� | ʵ������ | ���� |
| A | ����KSCN��F eC12��Һ eC12��Һ | ��� | C12���л�ԭ�� |
| B | KI-������Һ | ����ɫ | C12���������� |
| C | ��ɫʯ����Һ | �ȱ�����ɫ | C12����Ư���� |
D | ���з�̪��NaOH��Һ | ��ɫ | C12�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 MnO2��Ũ���ᷴӦ��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ��
MnO2��Ũ���ᷴӦ��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ�� mol Cl2���ɣ���������HCl�����ʵ����� mol��ת�Ƶ��ӵ����ʵ����� mol ��
mol Cl2���ɣ���������HCl�����ʵ����� mol��ת�Ƶ��ӵ����ʵ����� mol ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 1.12 g/mL)ǡ����ȫ���գ������Һ�к���NaClO�����ʵ���Ϊ0.0500 mol��
1.12 g/mL)ǡ����ȫ���գ������Һ�к���NaClO�����ʵ���Ϊ0.0500 mol�� �����������Ͳμӷ�Ӧ�����������ʵ���֮��n(Cl2) : n(H2)
�����������Ͳμӷ�Ӧ�����������ʵ���֮��n(Cl2) : n(H2) �Ƕ��٣���д����Ҫ�Ľ����̣�
�Ƕ��٣���д����Ҫ�Ľ����̣��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com