
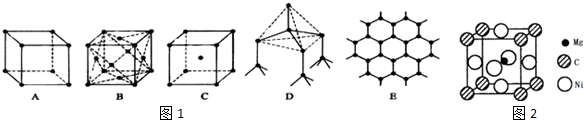
分析 (1)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子;由共价键结合形成的空间网状结构的晶体;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形;
(3)在NaCl晶胞中,每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,所以面对角线上的钠离子就有12个;
(4)CsCl的晶胞中铯离子和氯离子的配位数都是8,即每个铯离子周围有8个氯离子,每个氯离子周围也有8个铯离子;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;
(6)根据图知,同一个晶胞中每个Ni原子距离最近的Ni原子是4个,在空间中每个Ni原子距离最近的Ni原子是8个;根据均摊法确定化学式;晶胞质量=$\frac{M}{{N}_{A}}$g,上底面对角线长度=(2r2+2r3)pm=(2r2+2r3)×10-10cm,故晶胞棱长=$\frac{\sqrt{2}}{2}$×(2r2+2r3)×10-10cm=$\sqrt{2}$(r2+r3)×10-10cm,晶胞体积=[$\sqrt{2}$(r2+r3)×10-10cm]3=2$\sqrt{2}$(r2+r3)3×10-30cm3,其密度=$\frac{m}{V}$.
解答 解:(1)在金刚石晶胞中,每个碳可与周围四个碳原子形成共价键,将这四个碳原子连结起来后可以形成正四面体,体心有一个碳原子,所以图D为金刚石,每个碳原子与四个碳原子最近且距离相等;金刚石晶体是由共价键结合形成的空间网状结构的晶体属于原子晶体;
故答案为:D;4;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,形成六边形,所以图E为石墨的结构,为混合晶体,每个碳原子被三个六边形共用,所以每个正六边形占有碳原子数平均为6×$\frac{1}{3}$=2,
故答案为:E;2;
(3)在NaCl晶胞中,每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,所以图A为NaCl的结构,根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,形成12个面,所以面对角线上的钠离子就有12个,
故答案为:A;12;
(4)CsCl是由离子键形成的离子晶体,CsCl的晶胞中铯离子和氯离子的配位数都是8,即每个铯离子周围有8个氯离子,每个氯离子周围也有8个铯离子,所以图C为CsCl的结构;
故答案为:C;8;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体,
故答案为:B;12;
(6)根据图知,同一个晶胞中每个Ni原子距离最近的Ni原子是4个,在空间中每个Ni原子距离最近的Ni原子是8个;该晶胞中Mg原子个数=1、C原子个数=8×$\frac{1}{8}$=1,Ni原子个数=6×$\frac{1}{2}$=3,所以其化学式为MgNi3C;晶胞质量=$\frac{M}{{N}_{A}}$g,上底面对角线长度=(2r2+2r3)pm=(2r2+2r3)×10-10cm,故晶胞棱长=$\frac{\sqrt{2}}{2}$×(2r2+2r3)×10-10cm=$\sqrt{2}$(r2+r3)×10-10cm,晶胞体积=[$\sqrt{2}$(r2+r3)×10-10cm]3=2$\sqrt{2}$(r2+r3)3×10-30cm3,其密度=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}}{2\sqrt{2}({r}_{2}+{r}_{3})^{3}×1{0}^{-30}}$g•cm-3=$\frac{1{0}^{30}M}{2\sqrt{2}({r}_{2}+{r}_{3})^{3}{N}_{A}}$g•cm-3,
故答案为:8;MgNi3C;$\frac{1{0}^{30}M}{2\sqrt{2}({r}_{2}+{r}_{3})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、配位数的计算、化学式确定等知识点,侧重考查学生分析判断、计算及空间想象能力,注意均摊法的灵活运用,难点是(6)题晶胞体积的计算,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 铝表面有一层致密的氧化膜,故铝制容器可以用来腌制咸菜等 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH$\stackrel{pd}{→}$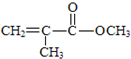 ,其过程符合绿色化学要求 ,其过程符合绿色化学要求 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.45mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油裂解主要目的是得到短链的不饱和烃 | |
| D. | 煤的气化与液化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴受热变成溴蒸气 | B. | 加热金刚石使之熔化 | ||
| C. | 加热食盐使之熔化 | D. | 加热碘化氢使之分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳是一种宝贵的碳氧资源.以C02和NH3
二氧化碳是一种宝贵的碳氧资源.以C02和NH3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com