
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式 __________________________________。
(3)写出下列反应的离子方程式:
①D+盐酸 ________________________________________________;
②B+水 _____________________________________________________;
③D+A ______________________________________________________。
【答案】 NaOH Na Na2CO3 NaHCO3 NaCl Na2O2 2Na2O2+2CO2=2Na2CO3+O2 HCO3-+H+=H2O+CO2↑ 2Na+2H2O=2Na++2OH-+H2↑ HCO![]() +OH-=H2O+CO32-
+OH-=H2O+CO32-
【解析】由焰色反应为黄色,且A、B、C、D均与盐酸反应生成E,知E为NaCl;B还生成可燃性气体知B为Na,无色无味气体H能使澄清石灰水变浑浊,则H为CO2,C、D还生成气体H使澄清石灰水变浑浊,知C、D为Na2CO3或NaHCO3,F和H(CO2)反应生成C和另一种气体,则F为Na2O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成Na2CO3,则A为NaOH。
(1)由以上分析可知A为NaOH,B为Na,C为Na2CO3,D为NaHCO3,E为NaCl,F为Na2O2;故答案为:NaOH;Na;Na2CO3;NaHCO3;NaCl;Na2O2;
(2)F为Na2O2,可与CO2反应生成Na2CO和O2,反应的方程式为2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)D为NaHCO3,与盐酸反应的离子方程式为HCO3-+H+=CO2↑+H2O,B为Na,与水反应生成NaOH和H2,反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,D为NaHCO3,A为NaOH,二者反应的离子方程式为HCO3-+OH-═H2O+CO32-;
故答案为:HCO3-+H+═H2O+CO2↑;2Na+2H2O═2Na++2OH-+H2↑;HCO3-+OH-═H2O+CO32-。


科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 氢是原子半径最小的元素 B. 稀有气体元素原子的最外层电子数均为8
C. 周期表中有7个主族、7个副族 D. 硫元素位于第三周期VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氧化还原反应的特征是电子的转移B.1molO2中含有的分子数为6.02×1023
C.常温下,可以用铝槽车运输稀硫酸D.Na2O可用作潜艇供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称"引火铁"。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和"引火铁",实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。

按要求填写下列空白:
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是___ ;烧瓶C的作用是___________________;在试管D中收集得到的是____________。
(2)实验时,U型管G中应加入的试剂是____________;长颈漏斗H中应加入____。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)____________。
(4)试管E中发生反应的化学方程式是______________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须_____;E管中的反应开始后,在F出口处应____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯水加热到较高温度,下列叙述正确的是
A.水的离子积变小,pH变大,呈碱性 B.水的离子积变大,pH变小,呈中性
C.水的离子积变大,pH变小,呈碱性 D.水的离子积不变,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:
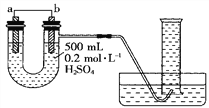
(1)b电极材料为__________,其电极反应式为_________________________。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为__________,此时a电极质量减少__________g。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有:_____________________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_________________________________________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有_____________________(答两种);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中涉及的反应物和生成物共有4种物质:X、Cl2、NH3、N2。当转移的电子总数 a个时,氮气数量变化了b mol。
(1)氧化产物的摩尔质量是________________。
(2)阿伏加德罗常数为(用含a、b的代数式表示)______________。
(3)X可能有两种组成:HCl或NH4Cl,为确定X的化学式,某同学取同温同压下体积分别为V1、V2的两种物质(氧化剂与还原剂)充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原温度后,再测出容器的容积(V3)。
①若实验结果(用V1、V2与V3间关系来表示,下同)是________________________,则X的化学式为HCl,简要写出你作出此推断的依据是_____________________。
②若实验结果是__________________,则X的化学式为NH4Cl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是最宝贵的资源之一,下列表述正确的是( )
A.水的电离过程是一个放热过程
B.温度升高,纯水中的c(H+)增大,显酸性
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丰富多彩的有机物存在许多性质的差异,下列描述正确的是( )
A. 聚氯乙烯能使溴水褪色
B. 淀粉和纤维素都是能发生水解反应的高分子化合物
C. 分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸
D. 苯酚在空气中变成粉红色,说明苯酚具有酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com