
| ���� |
| ���� |
A���÷�Ӧ��ƽ�ⳣ��Ϊ��K=
| ||
| B��CO��H2O��ת������ͬ | ||
| C��2min�ڣ���H2��ʾ�ķ�Ӧ����Ϊ��v��H2��=0��lmol/��L?min�� | ||
| D�������¶�ʱ��V����С��v������ |
| 0.4��0.4 |
| 0.6��0.4 |
| 2 |
| 3 |
| 0.4 |
| 1 |
| 0.4 |
| 0.8 |
| ||
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��40% | B��50% |
| C��60% | D��70% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
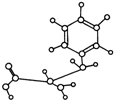
| A������NaOH������Ӧ�������������ᷴӦ |
| B���ܺϳɸ߷��ӻ����� |
| C���ܷ����ӳɷ�Ӧ |
| D���ܷ���ˮ�ⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2.5a��10-4mol |
| B��5a��10-4mol |
| C��7.5a��10-4mol |
| D��a��10-3mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���٢ܢޢ� | B���٢ۢޢ� |
| C���ڢۢݢ� | D���ڢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
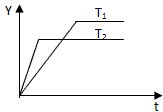 ��֪��ӦN2��g��+3H2��g��?2NH3��g������H��0����ijѹǿ�㶨������ɱ�������а������1��3����N2��H2����һ�������·�����Ӧ����ͼ��ij������Y��ʱ�䣨t���仯��ʾ��ͼ��Y�����ǣ�������
��֪��ӦN2��g��+3H2��g��?2NH3��g������H��0����ijѹǿ�㶨������ɱ�������а������1��3����N2��H2����һ�������·�����Ӧ����ͼ��ij������Y��ʱ�䣨t���仯��ʾ��ͼ��Y�����ǣ�������| A��N2��ת���� |
| B����������ƽ��Ħ������ |
| C����������� |
| D�����������ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
131 53 |
131 53 |
| A�����������Ϊ78 | ||
B����
| ||
| C��������Ϊ131 | ||
D����
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com