
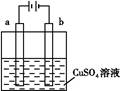
| A.若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-=Cu |
| B.若a和b为石墨,通电后滴入酚酞,a电极附近溶液呈红色 |
| C.若a为铜,b为铁,通电后Cu2+向a电极移动 |
| D.若a为粗铜,b为纯铜,通电后b电极质量增加 |
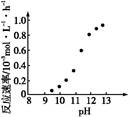


科目:高中化学 来源:不详 题型:单选题
| A.H2 | B.Ag | C.Cl2 | D.O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
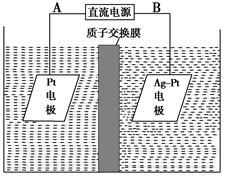
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
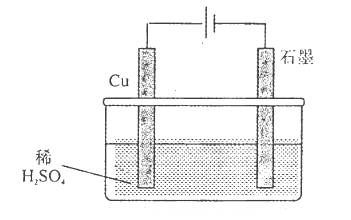
| A.电解初期,石墨电极上有H2产生 |
| B.整个电解过程中,H+的浓度不断增大 |
| C.电解一定时间后,石墨电极上有铜析出 |
D.电解初期,总反应方程式为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
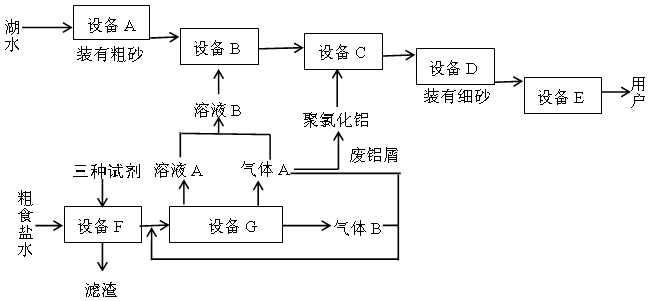

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgNO3 CuCl2 Cu(NO3)2 |
| B.KCl Na2SO4 CuSO4 |
| C.CaCl2 KOH NaNO3 |
| D.HCl HNO3 K2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
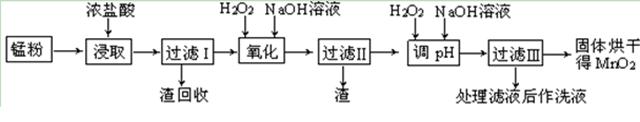
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
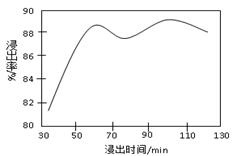
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
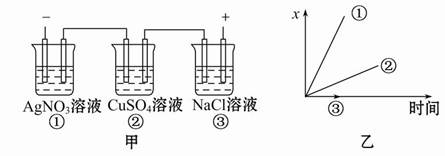
| A.各电解池析出气体体积总数的变化 |
| B.各电解池阳极质量的增加 |
| C.各电解池阴极质量的增加 |
| D.各电极上放电的离子总数的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com