
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(15分)下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气
(2)浓硫酸使木条变黑
(3)热的浓硫酸与铜片反应
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (选填①10mL、②50mL 、③100mL)规格的量筒;
查看答案和解析>>
科目:高中化学 来源:2011届贵州省遵义四中组团7校高三第一次联考(理综)化学部分 题型:实验题
(12分)为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;①称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(一)化学试卷(A卷)(带解析) 题型:实验题
[2012·杭州一模](10分)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr溶液、KI(含淀粉) 溶液、NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)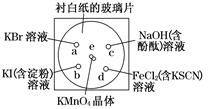
(1)e处反应的离子方程式为_____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为________________,d处的实验现象为___________________。
(3)c处反应的化学方程式为_____________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014届广东省珠海市高一上学期期末考试化学试卷(解析版) 题型:计算题
(12分)右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,该硫酸的物质的量浓度为 mol/L。配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (选填①10mL、②50mL 、③100mL)规格的量筒;
(3)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com