
工业上制硫酸时的一步主要反应是在接触室中生成SO3的反应:
2SO2(g)+O2(g)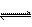 2SO3(g); △H<0,该反应的条件选择如下,其中可以完全用勒夏特列原理解释的是
2SO3(g); △H<0,该反应的条件选择如下,其中可以完全用勒夏特列原理解释的是
A.使用催化剂 B.400℃~500℃的高温 C.O2过量 D.采用常压
科目:高中化学 来源: 题型:
下列有关物质的性质与应用相对应的是( )
A.氢氟酸具有酸性,可用于雕刻玻璃
B.Na2O2具有强氧化性,可用作自来水的消毒剂
C.氯化铁溶液能氧化铜单质,可用于制作印刷电路板
D.SO2具有漂白性,可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
对已达化学平衡的下列反应 2X(g)+Y(g)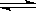 2Z(g)减小压强时,对反应产生的影响是( )
2Z(g)减小压强时,对反应产生的影响是( )
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.增加CO的物质的量 B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大 D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑ △H<0。下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)2C(g) (正反应吸热),平衡移动关系如图所示。下列说法正确的是
A.P1>P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3(g)燃烧生成NO2 (g)和H2O(g),已知
(1)2H2(g)+ O2 (g)=2H2O(g) △H =-483.6 kJ/mol
(2)N2 (g)+2O2 (g)=2NO2 (g) △H = + 67.8 kJ/mol
(3)N2 (g)+ 3H2 (g)=2NH3(g) △H =-92.0 kJ/mol
试计算后写出NH3(g)燃烧的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.在气体反应中,增大压强能使反应物中活化分子数和活化分子百分数同时增加
B.活化分子间的碰撞一定是有效碰撞
C.不同化学反应需要的活化能有可能差别很大
D.反应的活化能大小不会影响化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
部分弱酸的电离平衡常数如下表所示:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是( )
A.2CN-+H2O+CO2===2HCN+CO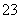
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-)
D.c(NH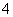 )相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com