
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+) | |
| C. | 25℃时pH=9、浓度均为0.1mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
分析 A.根据碳酸钠溶液中的质子守恒判断;
B.根据两溶液中的电荷守恒判断;
C.溶液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒及电荷守恒判断;
D.铵根离子部分水解,则c(SO42-)>c(NH4+).
解答 解:A.Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),即c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故A错误;
B.常温下,pH相等的氨水和NaOH溶液中c(OH-)相等,溶液中存在电荷守恒,根据电荷守恒得c(OH-)=c(NH4+)+c(H+)=c(Na+)+c(H+),相同温度下水的离子积常数相等,氢氧根离子浓度相等,则溶液中氢离子浓度相等,所以c(NH4+)=c(Na+),故B正确;
C.25℃时pH=9、浓度均为0.1mol/L的NH3•H2O、NH4Cl混合溶液,该溶液呈碱性,则NH3•H2O的电离程度大于NH4Cl的水解程度,则c(NH4+)>c(NH3•H2O),根据物料守恒c(NH4+)+c(NH3•H2O)=2c(Cl-)可知:c(NH4+)>c(Cl-)>c(NH3•H2O),结合电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-),故C正确;
D.0.1mol/L(NH4)2Fe(SO4)2溶液中,铵根离子部分水解,导致铵根离子浓度减小,则:c(SO42-)>c(NH4+),溶液中正确的离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故D错误;
故选BC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒、质子守恒的含义及在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA | |
| B. | 在标准状况下,22.4L空气中含有NA个单质分子 | |
| C. | 在18g18O2中含有NA个氧原子 | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下22.4LCCl4含有C-Cl键的数目为4NA | |
| B. | 电解精炼铜时,若转移的电子数为NA个,则阳极减小质量为32g | |
| C. | 电解旅58.5g熔融NaCl,标准状况能产生22.4L氯气、23.0g金属钠 | |
| D. | 己知N2(g)+3H2(g)=2NH3(g)△H=-40.3kJ•mol-1,则在相同条件下通入6molH2和2molN2进行该反应时放出热量小于80.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
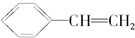 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 它能使溴水褪色,但不能使KMnO4酸性溶液褪色 | |
| B. | 它既能使溴褪色,也能使KMnO4酸性溶液褪色 | |
| C. | 它能发生加聚反应,生成物可用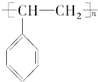 表示 表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ③④⑤⑥ | C. | ③⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中,反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为2Al3++3CO32-═2Al(OH)3↓+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com