
下图是Na2O2和CO2定性、定量实验的装置示意图。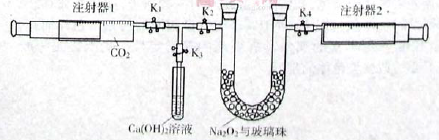
注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动。回答下列问题:(本题不考虑注射器内壁的磨擦阻力)
(1)U型管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是 。
(2)U型管中可观察到的反应现象是 。
(3)注射器I活塞推到底后,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是 。
(4)为了使剩余气体中二氧化碳能反应完,接下来的操作是 。
(5)要证明反应产物之一为氧气,最为方便的实验方法是 。
(6)本实验结束后固体产物板结,难以从U型管中取出,为了要证明固体产物中含有碳酸盐,实验时还需要从如下图示仪器和试剂中选择 (填字母)。当装置和药品都安装完毕后,接下来的操作步骤是 。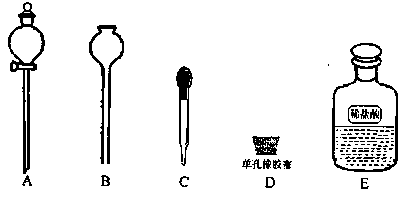
(15分)
增大过氧化钠和二氧化碳的接触面,使反应完全(2分)。
淡黄色粉末渐渐变白(2分)。
该反应为放热反应,使反应后气体温度升高,体积变大(2分)。
将注射器2中气体再推入U型管,反复数次(2分)。
打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃(2分)。
DEA(或DEC)(2分)
关闭K1、K4止水夹,打开K2、K3止水夹;打开分液漏斗活塞将稀盐酸滴入U型管中,观察试管内Ca(OH)2溶液是否变浑浊(3分)。
解析试题分析:
(1)过氧化钠分散在玻璃珠中,有利于增大过氧化钠与二氧化碳的接触面积,使反应更充分。
(2)过氧化钠与二氧化碳生成碳酸钠和氧气,过氧化钠为淡黄色固体、碳酸钠为白色固体。
(3)由2Na2O2+2CO2=2Na2CO3+O2知100mLCO2生成50mLO2,注射器2中收集到气体的体积大于50mL说明气体体积膨胀,推测过氧化钠与二氧化碳的反应放热。
(4)将注射器2中混合气体继续通入U型管,使二氧化碳反应完全。
(5)用带火星木条检验氧气。
(6)证明含有碳酸盐,可以向固体中加入盐酸,检验生成的二氧化碳气体。
考点: 化学实验


科目:高中化学 来源: 题型:实验题
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯: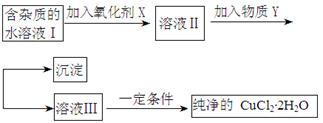
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 | 思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ | ①根据氧化还原反应原理,一般 物质有还原性, 物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 | ②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 | ④选择铁粉的原因是 (用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 | …… |
| …… | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4 ],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下: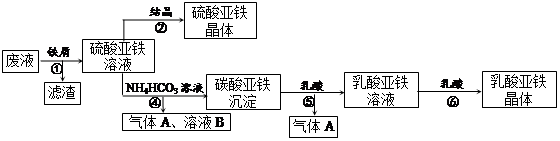
请回答:
(1)步骤①中分离操作的名称是_______;步骤⑥必须控制一定的真空度,原因是______________
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为_________
_ ;步骤④的离子方程式为____________________________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因______________________________。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:
_____ Fe2+ + _____ MnO4- + _____ H+ = _____Fe3+ +_____ Mn2+ +_____
取步骤②所得晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1 KMnO4溶液20.00mL,则所得晶体中FeSO4? 7H2O的质量分数为(以含a的式子表示) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.同体产物为MgO。
II.假设为______________。
III.假设为:______________。
请回答下列问题:
资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
(1)如图连接好仪器,装药品前如何检验装置的气密性_______。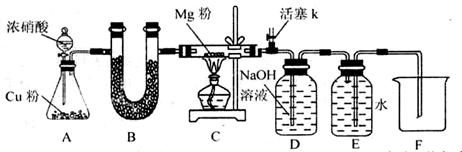
(2)装置B中盛装的干燥剂可以是(填序号)_______。
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的都是______________。
(4)E中收集到的气体对氢气的相对密度是14,该气体是_______。
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设_______成立。C中发生的化学反应方程式为______________
(6)本实验中存在明显缺陷,改进措施是___________
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A.青石棉是一种硅酸盐产品 |
| B.青石棉中含有一定量的石英晶体 |
| C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| D.1 mol青石棉能使1 mol HNO3被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向1.00L0.3mol·L-NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,有关该溶液
的说法正确的是
| A.溶质为Na2CO3 |
B.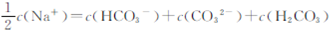 |
C.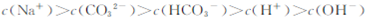 |
D.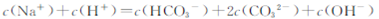 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质的性质与应用不相对应的是
| A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂 |
| B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 |
| C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 |
| D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com