
某化合物中含X,Y,Z三种元素,X为一种金属元素,其原子个数组成比为X∶Y∶Z=1∶2∶4.将1.98g该化合物溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应产生Fe2+.向反应后的溶液中加入适量KOH溶液使Fe2+刚好沉淀完全,过滤,将沉淀充分加热后,得到红色Fe2O3粉末2.4g.将滤液在一定条件下蒸干,只能得到一种纯净不含结晶水的含氧酸盐(不为复盐)6.96g.试通过计算推断该化合物的化学式.
|
解:原化合物中含铁元素为: 蒸干滤液后所得含氧酸盐为K2SO4. n(K+)= 沉淀: Fe2+需加KOH为:2×0.03mol=0.06mol 故原化合物中含K+为: 0.08mol-0.06mol=0.02mol 则原化合物含另一种元素为非金属元素(显负价),其质量为: 1.98g-(0.02mol×39g/mol+0.01mol×56g/mol)=0.64g 若铁为X,钾为Y,Z为非金属元素. 所以n(X)∶n(Y)∶n(Z)=0.01mol∶0.02mol∶z mol=1∶2∶4 所以Z元素的物质的量为0.04mol. 所以Z的摩尔质量为: 所以原化合物的化学式为K2FeO4. |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子K、L、M层电子数之比是1:4:1 |
| ③ | C | C是活泼非金属元素,其单质常温下呈气态但化学性质稳定 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物 |
| ⑥ | F | F元素的一种核素没有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

Ⅱ.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子方程式为:____________。
(2)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量的NaOH溶液反应的离子方程式为____________。
(3)将9 g Y单质在足量W单质中燃烧。所得气体通入1 L 1 mol·L-1的NaOH溶液中,完全吸收后,溶液中的离子浓度由大到小的顺序是____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省宝鸡市高三质检(一)理综化学试卷(解析版) 题型:填空题
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
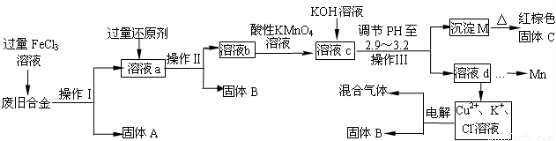
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是?????? 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:????????????????? 。
(3)过量的还原剂应是??????? ,溶液b中所含的金属阳离子有???????? 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为??????????????????? 。
②若用Xmol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为??????? g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:??? >??? >?? 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为????? L(用含Z的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com