
����Ŀ���������[aFe2��SO4��3b��NH4��2SO4cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȣ�ij����������������������������ƣ��������Ϊԭ�ϣ��������ͼ����������ȡ������泥� 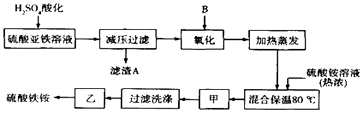
��ش��������⣺
��1������������Һ��H2SO4�ữ����ҪĿ����
��2���������������ʺϵ�������B�� ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������������ǣ��� ��
��4�����������У�����֮��ͼ�������֮ǰ����ȡ���������Լ��Ļ�ѧʽ������Fe2+�Ƿ���ȫ����������
��5����ȡ14.00g������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g����������һ����Һ�м���0.05mol Ba ��NO3��2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ ��
���𰸡�
��1��������Һ��SO42��Ũ�ȣ���Ca2+ת��Ϊ����ͬʱ����Fe2+ˮ��
��2��b
��3����ȴ�ᾧ
��4������������軯����Һ��������ɫ��������˵��������������
��5��Fe2��SO4��3?2��NH4��2SO4?2H2O
���������⣺��1���������ᣬ��������Һ��SO42��Ũ�ȣ���Ca2+ת��Ϊ����������CaSO4 �� ͬʱ����Fe2+ˮ�⣬
���Դ��ǣ�������Һ��SO42��Ũ�ȣ���Ca2+ת��Ϊ����ͬʱ����Fe2+ˮ�⣻��2��Ϊ�������������ʣ�Ӧ�����������Ϊ����������ԭ������ˮ��
��ѡb����3����80���·�Ӧ������������泥�������Ũ������ȴ�ᾧ������ϴ�ӣ����Բ�����Ϊ��ȴ�ᾧ��
���Դ��ǣ���ȴ�ᾧ����4�����������У�����֮��ͼ�������֮ǰ����ֹ������ˮ�⣬����Ҫ�����������ᣬ����Fe2+�Ƿ���ȫ���������ķ����ǣ�����Һ�м������軯����Һ��������ɫ��������˵�������������ӣ�
���Դ��ǣ�������������軯����Һ��������ɫ��������˵�������������ӣ���5����ȡ14.00g��Ʒ����������ˮ���ó�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g������ӦΪFe��OH��3 ��
n��Fe��OH��3��= ![]() =0.02mol��
=0.02mol��
����һ����Һ�м���0.05mol Ba��NO3��2��Һ��ǡ����ȫ��Ӧ����n��SO42����=0.05mol��
����14.00g��Ʒ�к���Fe2��SO4��30.02mol��n��SO42����Ϊ0.1mol����NH4��2SO4Ϊ0.1mol��0.02mol��3=0.04mol��
��m��H2O��=14.00g��0.02mol��400g/mol��0.04mol��132g/mol=0.72g��
n��H2O��= ![]() =0.04mol��
=0.04mol��
n��Fe2��SO4��3����n����NH4��2SO4����n��H2O��=0.02��0.04��0.04=1��2��2��
���Ի�ѧʽΪFe2��SO4��32��NH4��2SO42H2O��
���Դ��ǣ�Fe2��SO4��32��NH4��2SO42H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������NF3����һ�����͵��Ӳ��ϣ����ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3 �� �����Ҫ��ش��������⣺
��1����Ӧ�����У��������뱻��ԭ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ ��
��2��д���÷�Ӧ�Ļ�ѧ����ʽ �� ����Ӧ������0.2mol HNO3 �� ת�Ƶĵ�����ĿΪ����
��3��NF3��һ����ɫ���������壬��һ��NF3�ڿ�����й©���������ڷ��֣����жϸ�����й©ʱ�������� ��
��4��һ��NF3й©��������NaOH��Һ���ܵķ���������Ⱦ��������NaNO2��NaF��H2O�⣬���϶������ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤������������˵����ȷ���ǣ� �� 
A.��״���£�22.4L HF�к��з�ԭ����ĿΪNA
B.0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ��c��NH4+����c��OH������c��SO42������c��H+��
C.1mol ��ͼ������Ũ��ˮ��Ӧʱͨ���������Br2Ϊ6mol
D.12gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ����������Ӧ�ù㷺�������������⣮
��1������ͭ��Һʱ���������ж���һ�ֽⶾ����
P4+CuSO4+H2O��Cu3P+H3PO4+H2SO4 �� ��6molH3PO4���ɣ���CuSO4������P4�����ʵ���Ϊ ��
��2�����Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㣮��CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3��g��+CO2��g��=NH2CO2NH4��s������H=��159.47kJmol��1
��NH2CO2NH4��s��=CO ��NH2��2��s��+H2O��g������H=a kJmol��1
��2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��g������H=��86.98kJmol��1
��aΪ ��
��3����ͼ��ʾʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ����������ṩ������ͬʱ����ʵ�ֵ��̶�������ȼ�ϵ�أ���д���õ�ص�������Ӧʽ �� �����пɷ����������A�Ļ�ѧʽΪ �� 
��4�������£���0.1mol/L��ˮ�м�������N2O5 �� ʹ��Һ��c��NH3H2O����c��NH4+��=5��9����ʱ��Һ��pH= �� ��25��ʱ��NH3H2O�ĵ��볣��Kb=1.8��10��5��
��5��SiO2��������������һ�ּ�ǿ�Ķ�Ԫ���ˮ��������������3��Ԫ����ɣ����з��������������Ϊ79.17%����д��SiO2�������������ӷ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA ��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.1mol������CH3������10NA������
B.���³�ѹ�£�71gCl2���е���ԭ����Ϊ2NA
C.1molL��1NaCl��Һ�к��е�������ΪNA
D.��״���£�11.2L CH3CH2OH �к��еķ�����ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ���ʵ��������и�������ȫȼ�պ��������������ǣ� ��
A.����
B.����
C.��ϩ
D.��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹʱϩ����������ϲ���Ӧ������ʱ��Ӧ�����������ʵ��Ĵ�������ʱ��������Ӧ�����飬һ����Ϊ���ⷴӦ���ڴ���������С���Ӧ���̵�ʾ��ͼ���£�
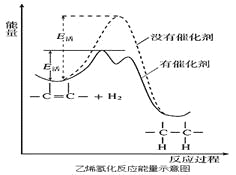
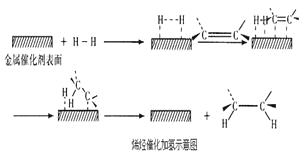
����˵������ȷ����
A. ��ϩ��H2��������ķ�Ӧ�����ȷ�Ӧ
B. ����������ɼ�С��Ӧ����ЧӦ
C. �����ܸı�ƽ��ת���ʣ����ܸı仯ѧƽ�ⳣ��
D. ����������н����⻯���һ����ԭ�Ӻ�˫��̼ԭ���Ƚ�ϣ��õ��м���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijģ�⡰�˹���Ҷ���绯ѧʵ��װ����ͼ��ʾ����װ���ܽ�H2O��CO2ת��ΪO2��ȼ�ϣ�C3H8O��������˵����ȷ���ǣ� �� 
A.a�缫�ķ�ӦΪ��3CO2+18H++18e��=C3H8O+5H2O
B.��װ�ù���ʱ��H+��b������a����Ǩ��
C.ÿ����1molO2 �� ��44gCO2����ԭ
D.��װ�ý���ѧ��ת��Ϊ���ܺ͵���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�����ֶ�����Ԫ�أ�AԪ�����ڵ�������������������ԭ����������ȣ�Bԭ�ӵ������������Ǵ�����������3����C�ǵ�������ԭ�Ӱ뾶����Ԫ�أ�D�ĵ��ʹ�ҵ��������Ư�ۣ�Ҳ��������ˮ����������Ԫ�ط��Ż�ѧʽ�ش��������⣺
��1��CԪ�������ڱ��е�λ�� �� D�ĵ�����ˮ��Ӧ�����ӷ���ʽΪ ��
��2��C�����ӽṹʾ��ͼΪ �� A��B��C�γɵĻ�����ĵ���ʽΪ ��
��3��B��C�γɵĻ������������������д������ʱ�����Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com