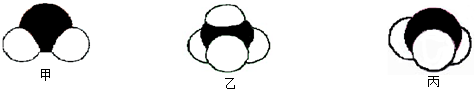
Θ®2010?≥γΈΡ«χ“ΜΡΘΘ©ΥΡ÷÷ΕΧ÷ήΤΎ‘ΣΥΊAΓΔBΓΔCΓΔDΒΡ–‘÷ ΜρΫαΙΙ–≈œΔ»γœ¬ΘΚ
–≈œΔΔΌ‘≠Ή”ΑκΨΕ¥σ–ΓΘΚAΘΨBΘΨCΘΨD
–≈œΔΔΎΥΡ÷÷‘ΣΥΊ÷°Φδ–Έ≥…ΒΡΡ≥»ΐ÷÷Ζ÷Ή”ΒΡ±»άΐΡΘ–ΆΦΑ≤ΩΖ÷–‘÷ ΘΚ

«κΗυΨί…œ ω–≈œΔΜΊ¥πœ¬Ν–Έ ΧβΘ°
Θ®1Θ©B‘ΣΥΊ‘Ύ÷ήΤΎ±μ÷–ΒΡΈΜ÷Ο
ΒΎ2÷ήΤΎIVAΉε
ΒΎ2÷ήΤΎIVAΉε
Θ§«κ–¥≥ωBC
2Ζ÷Ή”ΒΡΒγΉ” Ϋ
Θ°
Θ®2Θ©AΥυ‘Ύ÷ήΤΎ÷–Θ§E‘ΣΥΊΒΡΒΞ÷ ΜΙ‘≠–‘Ήν«ΩΘ§F‘ΣΥΊΒΡΡ≥–©―Έάύ≥Θ”ΟΉςΨΜΥ°ΦΝΘ°EΒΞ÷ ”κΦΉΖ¥”Π”–Μ·ΚœΈοX…ζ≥…Θ°«κ–¥≥ω“‘œ¬ΝΫΗωΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘ°
ΔΌA‘ΣΥΊΒΡΒΞ÷ ”κΈο÷ ΦΉΖΔ…ζΒΡΖ¥”Π
Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
Θ°
ΔΎFΓΔCΝΫ÷÷‘ΣΥΊΉι≥…ΒΡΜ·ΚœΈοYΩ…ΉςΈΣΗΏΈ¬ΫαΙΙΧ’¥…≤ΡΝœΘ§X”κYΝΫ÷÷Μ·ΚœΈο‘Ύ»ή“Κ÷–ΖΔ…ζΒΡΖ¥”Π
Al2O3+2OH-®T2AlO-2+H2O
Al2O3+2OH-®T2AlO-2+H2O
Θ°
Θ®3Θ©Έο÷ ΕΓΒΡ‘ΣΥΊΉι≥…ΚΆΦΉœύΆ§Θ§ΕΓΖ÷Ή”ΨΏ”–18ΒγΉ”ΫαΙΙΘ°œρ Δ”–“ΜΕ®≈®Ε»ΕΓ»ή“ΚΒΡ ‘Ιή÷–Θ§÷πΒΈΦ”»κ”Ο…ΌΝΩœΓΝρΥαΥαΜ·ΒΡΝρΥα―«Χζ»ή“ΚΘ°ΒΈΦ”Ιΐ≥Χ÷–ΒΡœ÷œσ «ΘΚ
ΔΌ«≥¬Χ…Ϊ»ή“Κ±δ≥……νΉΊΜΤ…ΪΘ§ΔΎ”–…ΌΝΩΤχ≈ί≥ωœ÷Θ®Ψ≠―ι÷Λ «―θΤχΘ©Θ§Τ§ΩΧΚσΖ¥”Π±δΒΟΨγΝ“Θ§≤ΔΖ≈≥ωΫœΕύ»»ΝΩΘ§ΦΧ–χΒΈΦ”»ή“ΚΘ§Ψ≤÷Ο“ΜΕΈ ±ΦδΘ§Δέ ‘ΙήΒΉ≤Ω≥ωœ÷ΚλΚ÷…Ϊ≥ΝΒμΘ°œρΉ«“Κ÷–‘ΌΒΈ»κœΓΝρΥαΘ§≥ΝΒμ»ήΫβΘ§»ή“Κ≥ ΜΤ…ΪΘ°«κ”ΟΜ·―ßΖΫ≥Χ ΫΜράκΉ”ΖΫ≥Χ ΫΦΑ±Ί“ΣΒΡΈΡΉ÷Ϋβ ΆΔΌΓΔΔΎΓΔΔέ÷–Φ”ΒψΒΡΉ÷Θ°ΔΌ
ΖΔ…ζΖ¥”Π2Fe2++H2O2+2H+=2Fe3++2H2OΘ§«≥¬Χ…ΪFe2+±ΜΙΐ―θΜ·«β―θΜ·≥…ΜΤ…ΪFe3+
ΖΔ…ζΖ¥”Π2Fe2++H2O2+2H+=2Fe3++2H2OΘ§«≥¬Χ…ΪFe2+±ΜΙΐ―θΜ·«β―θΜ·≥…ΜΤ…ΪFe3+
ΔΎ
Ιΐ―θΜ·«βΖ÷ΫβΩ…≤ζ…ζ―θΤχΘ§≥ΘΈ¬ ±Ζ¥”Π2H2O2=2H2O+O2ΓϋΫœ¬ΐΘ§“ρΕχΩΣ ΦΤχ≈ί…ΌΘΜ ή»»≤Δ«“±Μ÷πΫΞ‘ωΕύΒΡFe3+¥ΏΜ·Θ§ ΙΖ¥”ΠΥΌ¬ Φ”ΩλΕχΨγΝ“
Ιΐ―θΜ·«βΖ÷ΫβΩ…≤ζ…ζ―θΤχΘ§≥ΘΈ¬ ±Ζ¥”Π2H2O2=2H2O+O2ΓϋΫœ¬ΐΘ§“ρΕχΩΣ ΦΤχ≈ί…ΌΘΜ ή»»≤Δ«“±Μ÷πΫΞ‘ωΕύΒΡFe3+¥ΏΜ·Θ§ ΙΖ¥”ΠΥΌ¬ Φ”ΩλΕχΨγΝ“
Δέ
»ή“Κ÷–¥φ‘ΎΤΫΚβFe3++2H2O?FeΘ®OHΘ©3+3H+Θ§Ζ¥”ΠΔΌ ΙcΘ®H+Θ©ΫΒΒΆ«“Ζ¥”ΠΔΎΖ≈»»Θ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Β±Υ°Ϋβ≥ωΒΡFeΘ®OHΘ©3ΫœΕύ ±ΨΆΨέΦ·ΈΣ≥ΝΒμ
»ή“Κ÷–¥φ‘ΎΤΫΚβFe3++2H2O?FeΘ®OHΘ©3+3H+Θ§Ζ¥”ΠΔΌ ΙcΘ®H+Θ©ΫΒΒΆ«“Ζ¥”ΠΔΎΖ≈»»Θ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§Β±Υ°Ϋβ≥ωΒΡFeΘ®OHΘ©3ΫœΕύ ±ΨΆΨέΦ·ΈΣ≥ΝΒμ
Θ°

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ