
| A. | ①③④② | B. | ①③②④ | C. | ③④②① | D. | ③①②④ |
分析 组成原电池时,负极金属较为活泼,可根据电子、电流的流向以及反应时正负极的变化判断原电池的正负极,据此判断金属的活泼性强弱.
解答 解:组成原电池时,负极金属较为活泼,
①②相连时,外电路电子从①流向②,说明①为负极,活泼性①>②;
①③相连时,①为负极,则活泼性①>③;
②④相连时,②上有气泡逸出,应为原电池的正极,活泼性④>②;
③④相连时,③的质量减少,③为负极,活泼性③>④;
综上分析可知金属的活泼性从大到小的顺序为:①>③>④>②,
故选A.
点评 本题考查金属活泼性的判断,题目难度不大,侧重于原电池的考查,注意原电池的组成特点以及工作原理,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
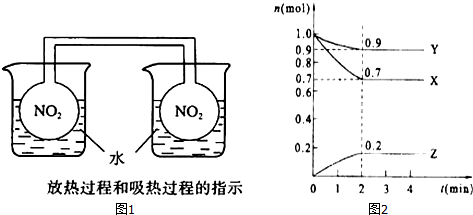
 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色、黑色、白色 | B. | 红色、白色、白色 | C. | 红色、红色、红色 | D. | 黑色、红色、白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由反应:2Fe2++Cl2→2Fe3++2Cl-,可以得出还原性Cl2<Fe3+ | |
| B. | 由于钢铁表面水膜里溶有氧气和二氧化碳,所以日常的金属腐蚀以析氢腐蚀为主 | |
| C. | 将钢铁接在外电源的负极上,另一金属(不是惰性金属)接在外电源的正极上组成电解池,可以防钢铁腐蚀 | |
| D. | 纯锌与稀硫酸反应比不纯的锌(一般含铁、铜等杂质)与相同的稀硫酸反应慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式: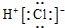 | B. | CO2分子的结构式:O=C=O | ||
| C. | Na的原子结构示意图: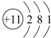 | D. | 钙离子的电子式:Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
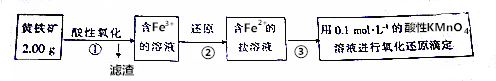
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | CO | C. | SiO2 | D. | H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com