
| A. | $\frac{b}{2a}$mol-1 | B. | $\frac{a}{4b}$mol-1 | C. | $\frac{a}{b}$mol-1 | D. | $\frac{b}{a}$mol-1 |
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46gNO2与N2O4的混合气体中含有的原子数为3NA | |
| B. | 15.6g Na2O2与过量CO2反应时,转移的电子数为0.4NA | |
| C. | 常温常压下,11.2L二氧化硫中所含的氧原子数等于NA | |
| D. | 1L1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充入1mol稀有气体氦(He),平衡将不发生移动 | |
| B. | 充入A、B、C各1mol,平衡将向正反应方向移动 | |
| C. | 将A、B、C各物质的物质的量都减半,C的百分含量不变 | |
| D. | 加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、NO3- | B. | Na+、K+、Al3+、NO3- | ||
| C. | K+、Mg2+、Cl-、SO42- | D. | NH4+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
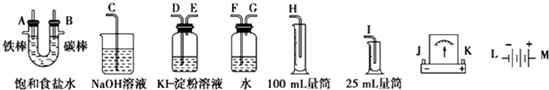
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 反应物 | 在相同温度下测得的反应速率v/mol•L-1•min-1 | |
| 大小相同的金属片 | 酸溶液 | ||
| 1 | 镁条 | 1 mol•L-1盐酸 | v1 |
| 2 | 铁片 | 1 mol•L-1盐酸 | v2 |
| 3 | 铁片 | 0.1 mol•L-1盐酸 | v3 |
| A. | v1>v2>v3 | B. | v3>v2>v1 | C. | v1>v3>v2 | D. | v2>v3>v1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发:应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏:开始蒸馏时应先加热再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 | |
| C. | 分液:下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯 | |
| D. | 量取:用规格为10mL的量筒量取8.0mL液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com