


科目:高中化学 来源:不详 题型:单选题
A.c(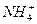 ) ) | B.c(NH3·H2O) |
| C.c(OH-) | D.c(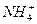 )与c(NH3·H2O)的比值 )与c(NH3·H2O)的比值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡等体积混合 |
| C.pH=3的醋酸和pH=11的氢氧化钡等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.cα | B.KW/c(OH-) | C.c(NH3·H2O)/c([NH4+] | D.KW/α |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.C(s)+
| ||
| B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ?mol-1 | ||
| C.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1 | ||
D.CO(g)+
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
C(g)+D(g)过程中的能量变化如图所示,由此可判断( )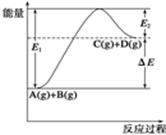
| A.1molA与1molB充分反应后,能量变化为ΔE |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com