
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是

选项 | X | Y | Z |
A | NH3 | NO2 | HNO3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | CO2 | Na2CO3 | NaHCO3 |
A. A B. B C. C D. D
【答案】A
【解析】A.氨气催化氧化生成NO,得不到二氧化氮,物质之间通过一步反应不可以实现,故A选;B.二氧化硅和碳酸钠高温反应生成硅酸钠,硅酸钠和稀盐酸反应生成硅酸,硅酸分解生成二氧化硅,硅酸与氢氧化钠反应生成硅酸钠,各物质之间通过一步反应可以实现,故B不选;C.氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠与碳酸反应生成氢氧化铝,氢氧化铝与氢氧化钠反应生成偏铝酸钠,氢氧化铝分解生成氧化铝,各物质之间通过一步反应可以实现,故C不选;D.二氧化碳与氢氧化钠反应生成碳酸钠,碳酸钠溶液中通入二氧化碳反应生成碳酸氢钠,碳酸氢钠与氢氧化钠反应生成碳酸钠,碳酸氢钠与酸反应生成二氧化碳,各物质之间通过一步反应可以实现,故D不选;故选A。


科目:高中化学 来源: 题型:
【题目】下列生活生产中常见物质的主要成分的化学式与名称相对应的是
A. 光导纤维——SiO2 B. 漂粉精——Ca(C1O3)2
C. 碱石灰——Na2CO3 D. 绿矾一Fe2(SO4)3·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
己知:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)= ______________。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO 和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5![]() 10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率为α2,则α1 ____α2 (填“>”、“<”或“=”);平衡常数K____ (填增大”“减小 ”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下线路合成有机化合物F:
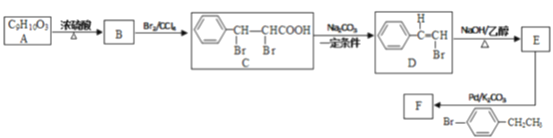
已知:R-C≡CH+R-Br![]() R-C≡C-R+HBr
R-C≡C-R+HBr
(1)B中官能团的名称是______,E的化学名称是_______;
(2)F的结构简式为____,由D生成E的反应类型是_______;
(3)试推断在核磁共振氢谱中A有多少组峰__;
A.8 组 B.9 组 C.7 组
(4)写出C与足量NaOH 溶液在加热条件下反应的化学方程式:____________;
(5)2 分子A在一定条件下反应生成一种含有3个六元环的化合物,该生成物的结构简式为_______ ;
(6) 同时满足下列条件的A 的同分异构体有___种( 不考虑立体异构)。
①属于芳香族化合物;
②能与碳酸氢钠溶液反应生成CO2;
③在一定条件下能发生催化氧化,且其产物能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在100 ℃下,水的离子积KW=1×10-12,下列说法正确的是( )
A. 0.05 mol/L的H2SO4溶液pH=1
B. 0.001 mol/L的NaOH溶液pH=11
C. 0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合后溶液pH为6,溶液显酸性
D. 完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
A. 断开一个N≡N键的同时有6个N—H键生成
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. N2、H2、NH3分子数比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com