
分析 ①根据配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等,根据配制步骤判断使用的仪器;
②带有活塞或旋塞的仪器要检查是否漏水;
③根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀.
解答 解:①用NaOH固体配制480ml 2mol•L-1的NaOH溶液,操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,冷却后转移到500ml容量瓶中(实验室无480mL容量瓶),并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管,故还需要仪器为:500ml容量瓶;胶头滴管,
故答案为:500ml容量瓶;胶头滴管;
②用于盛装液体的、带活塞或塞子的仪器在使用前要查漏,容量瓶有塞子,使用前需要检查是否漏水,萃取时也需要同样操作的仪器是分液漏斗,
故答案为:检漏;分液漏斗;
③根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量(B)、溶解转移(EAG)、洗涤转移(C)、定容摇匀(DF),
故答案为:B E A G C D F.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和实验步骤是解题关键,题目难度不大,试题培养了学生的分析能力及化学检验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
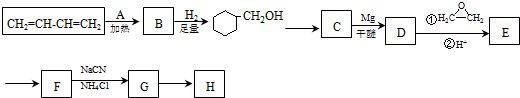
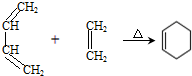

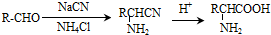
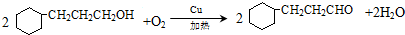 .
.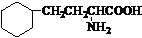 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式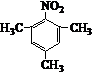 、
、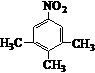 .
.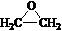 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
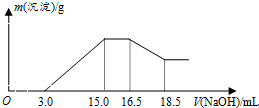
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
| 丙烯酸 | 142℃ | 与水互溶,易溶于有机溶剂 | 54℃ | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 11℃ | 有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
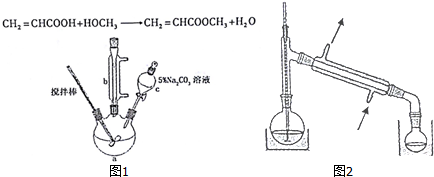
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 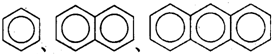 互为同系物 互为同系物 | |
| C. | 四氯乙烯分子中所有原子都处于同一平面 | |
| D. | 扁桃酸(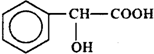 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
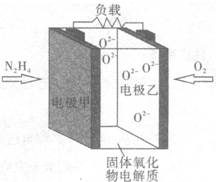 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为N2H4+2O2═2NO+2H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com