
根据有机化合物的命名原则,下列命名正确的是( )
A.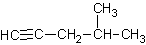 4-甲基-1,2-戊炔
4-甲基-1,2-戊炔
B.CH3 CH (CH3)CH=CHCH3 2-甲基-3-戊烯
C. 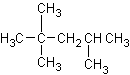 2, 2, 3-甲基戊烷
2, 2, 3-甲基戊烷
D.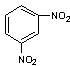 间二硝基苯
间二硝基苯
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处
理,使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②____Na2FeO2+____NaNO2+____H2O―→____Na2Fe2O4+____NH3↑____+NaOH
③Na2FeO2+Na2Fe2O4+2H2OFe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为________,被还原的是______________________。若有1 mol Na2FeO2生成,则反应中有____ mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是________。
A.该生产过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
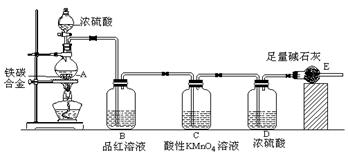
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应; ② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为 (写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是
(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
书写电子式或用电子式回答下列问题
① NaOH ② Mg2+
③ O=C=O ④ CCl4
⑤用电子式表示H2O形成过程
⑥用电子式表示硫化钠形成过程
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中的分子之间能形成氢键,且表示方法正确的是( )
A. H2O: H—O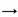 H B. H2S: H—S…H
H B. H2S: H—S…H
C. HCHO: C=O…H D. NH3: N—H…N
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体的说法中一定正确的是( )
①依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体; ②由原子直接构成的晶体就是原子晶体; ③分子晶体的堆积均采取分子密堆积 ;④NaF、MgF2 、SiF4三种晶体的熔点依次升高;⑤金属键只存在于金属晶体中; ⑥离子键只存在于离子晶体中; ⑦H2O的性质非常稳定,原因在于分子之间存在氢键; ⑧SO2和SiO2晶体在熔化时破坏的作用力相同
A.①⑤⑥⑦ B.只有⑥ C.②③⑤⑥ D.①②⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为 ( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com