
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
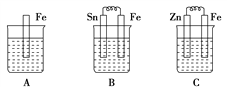
①B中Sn极的电极反应式为_______;Sn极附近溶液的pH(填“增大”、“减小”或“不变”)______。
②C中总反应离子方程式为_______________。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
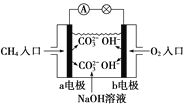
①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_______________________。
②常温下,如果该原电池电解质溶液为pH=13的氢氧化钠500mL,构成原电池一段时间后pH变为12,则构成原电池消耗了标准状况下__________ mL甲烷,(假设化学能全部转化为电能,忽略氢氧化钠溶液的体积变化)
【答案】 2H++2e-=H2↑ 增大 Zn+2H+=Zn2++H2 B>A>C a CH4-8e-+10OH-=CO32-+7H2O 504
【解析】⑴. ①.在B装置中,Fe为负极,Sn为正极,在正极上氢离子放电生成氢气,则在Sn极的电极反应式为:2H++2e-=H2↑;在Sn电极,因消耗H+,故pH增大;故答案为:2H++2e-=H2↑;增大;
②.在C装置中,Zn易失电子作负极,Fe作正极,本原电池装置实质上相当于锌和氢离子之间的置换反应,则总反应方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
③.在A装置中,Fe发生化学腐蚀,B装置中Fe为负极,Sn为正极,Fe被腐蚀,C装置中Zn为负极,Fe为正极,Fe受到保护,因腐蚀速率:原电池引起的腐蚀>化学腐蚀>受到保护的腐蚀,故答案为:B>A>C;
⑵. ①.在燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,所以a极是负极,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案是:a;CH4-8e-+10OH-=CO32-+7H2O;
②.常温下,pH=13的NaOH溶液中c(OH-)=0.1mol/L,pH=12的NaOH溶液中c(OH-)=0.01mol/L,该原电池的总反应式为:CH4+2O2+2OH-=CO32-+3H2O,构成原电池一段时间后,NaOH溶液中氢氧根离子减少了n(OH-)=0.5L×0.1mol/L-0.5L×0.01mol/L=0.045mol,根据总反应式,则消耗标准状况下甲烷的体积是:0.045mol÷2×22.4L/mol=0.504L,即504mL,故答案是:504。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组想从FeI2溶液中获得碘单质,其设计流程如图。
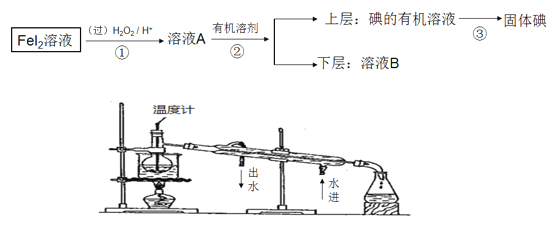
请回答:
(1)操作②中除烧杯外,还要用到的玻璃仪器的名称是________________
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如图的实验装置,此装置中的明显错误是___________________________________
(3)溶液B呈黄色,除了含Fe3+,可能还含有I2,请你设计一个实验方案加以证明,你的实验操作方案是__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会开幕式文艺表演中的“文房四宝”展示了悠久的中华文明,其中“宣纸”的主要成分是纤维素[(C6H10O5)n]。下列关于纤维素说法正确的是
A. 属于烃 B. 属于糖类 C. 属于油脂 D. 属于蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物2.3克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重2.7克与4.4克,该有机物可能是( )
A.CH4
B.C2H4
C.C2H6
D.C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KC1O3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为_________________________________________________________。
(2)反应②中,氧化产物与还原产物的质量比为____________________________。
(3)请将反应③配平:_____KMnO4+_____HCl(浓)=_____KCl+____MnCl2+_____Cl2↑+_____H2O
(4)若要制得相同质量的氯气,反应中电子转移的数目之比(①:②:③)为___________________。
(5)己知反应④:4HCl(g)+O2![]() 2Cl2+2H2O(g),该反应也能制得氯气,则 MnO2、O2、KMnO4。三种物质氧化性由强到弱的顺序为____________________________________________。
2Cl2+2H2O(g),该反应也能制得氯气,则 MnO2、O2、KMnO4。三种物质氧化性由强到弱的顺序为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学平衡状态的标志是
A. 反应停止了
B. 正反应速率与逆反应速率均为零
C. 反应物和生成物浓度相等
D. 正反应速率与逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是35%
C. 增加C,B的平衡转化率不变
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com