


科目:高中化学 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:实验题
硫酸是工业生产中重要的产品之一,以黄铁矿为原料生产硫酸的简单流程如下图所示。
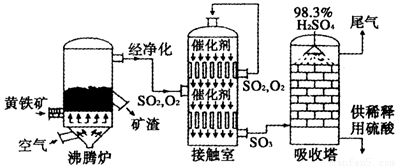
请填写下列空白。
(1)黄铁矿燃烧生成SO2的化学方程式为_____________;接触室中发生反应的化学方程式为____________________。
(2)为充分利用反应放出的热量,接触室中应安装_____________(填设备名称);吸收塔中填充有许多瓷管,其作用为__________________。
(3)为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为____________________(设空气中氧气的体积分数为0.20);将上述炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为________________%。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式为___________________。
(5)硫酸的用途非常广泛,可应用于下列____________(可多选)。
a.橡胶的硫化 b.过磷酸钙的制备
c.铅蓄电池的生产 d.表面活性剂“烷基苯磺酸钠”的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com