
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为??????????????? 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为????????????????????????????? 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式?????????????????????????? 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K=??????? 。
Y2O3(g),其平衡常数表达式为K=??????? 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g)?? △H=+180 kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为???????????????????? 。
(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
〔或2H2SO4(浓)+ Cu  CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
或2H2SO4(浓)+ S  3SO2↑+ 2H2O等合理答案〕(3分)
3SO2↑+ 2H2O等合理答案〕(3分)
(2)c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-)(2分)???
(3)Al2O3+2OH-=2AlO2-+H2O(3分)
(4)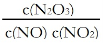 (2分)
(2分)
(5)4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1(3分)
【解析】
试题分析:与酸雨有关的两种氧化物为二氧化硫和氮的氧化物,X元素的原子序数大于Y,故XY分别为S和N,Z为Al。(1)实验室中一般用浓硫酸和Na2SO3反应或与铜反应制取二氧化硫;(2)NaHSO3溶液存在HSO3-的电离和水解平衡,根据溶液为酸性,确定以电离为主,故由大到小的顺序为c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-);(5)①-②×2得出对应热化学方程式4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1
考点:考查物质结构、热化学方程式书写、离子浓度大小比较等有关问题。


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol-L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com