
【题目】已知某酸HA的电离常数Ka=2.0×10﹣8 , 用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( ) 
A.a点溶液的pH=4
B.b点溶液中存在:c(A﹣)>c(Na+)>c(H+)=c(OH﹣)
C.b点c(HA)/c(A﹣)=5
D.c点c(A﹣)+c(H+)=c(Na+)+c(OH﹣)
【答案】C
【解析】解:A.设2mol/LHA溶液中电离出氢离子浓度为x,则c(A﹣)≈c(H+)=x,c(HA)≈2mol/L,HA的电离常数Ka= ![]() =2.0×10﹣8 , 解得x=2×10﹣4mol/L,则a点溶液的pH=﹣lg2×10﹣4=4﹣lg2≈3.7,故A错误; B.b点溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒可知:c(A﹣)=c(Na+),正确的离子浓度大小为:c(A﹣)=c(Na+)>c(H+)=c(OH﹣),故B错误;
=2.0×10﹣8 , 解得x=2×10﹣4mol/L,则a点溶液的pH=﹣lg2×10﹣4=4﹣lg2≈3.7,故A错误; B.b点溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒可知:c(A﹣)=c(Na+),正确的离子浓度大小为:c(A﹣)=c(Na+)>c(H+)=c(OH﹣),故B错误;
C.根据图象可知,b点溶液呈中性,则1×10﹣7mol/L,根据Ka= ![]() 可知:
可知: ![]() =
= ![]() =
= ![]() =5,故C正确;
=5,故C正确;
D.c点溶液呈碱性,则c(OH﹣)>c(H+),根据电荷守恒可知:c(Na+)>c(A﹣),则c(A﹣)+c(H+)<c(Na+)+c(OH﹣),故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】CaCO3的摩尔质量为100g/mol,将5.0g CaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100mL溶液.该溶液中Ca2+ 的物质的量浓度为( )
A. 5.0 mol/L B. 0.50 mol/L C. 1.0 mol/L D. 0.10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应NO2(g)+CO(g)=NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是

A. 图中A→B的过程为放热过程
B. 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C. 该反应为氧化还原反应
D. 1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8 ![]() 8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( )
8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( ) 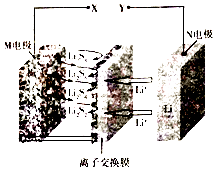
A.电池充电时X为电源负极
B.放电时,正极上可发生反应:2Li++Li2S4+2e﹣=2Li2S2
C.充电时,没生成1molS8转移0.2mol电子
D.离子交换膜只能通过阳离子,并防止电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,其过程表示为:
CuSO45H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s)=Cu2+(aq)+SO42﹣(aq) 热效应为△H2;CuSO45H2O受热分解的化学方程式为:CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
A.△H1<△H3
B.△H2>△H3
C.△H1+△H3=△H2
D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.水电离的c(H+)=1×10﹣13mol?L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
C.![]() =1×10﹣13mol?L﹣1的溶液中:NH4+、Ba2+、Cl﹣、NO3﹣
=1×10﹣13mol?L﹣1的溶液中:NH4+、Ba2+、Cl﹣、NO3﹣
D.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com