
【题目】下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | X | Y | Z |
A | Fe | FeCl3 | FeCl2 |
B | Cl2 | NaClO | NaCl |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
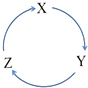
A.A
B.B
C.C
D.D
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】把1 mol甲烷和4mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象
①黄绿色逐渐消失
②试管壁上有油珠
③试管内水面上升
④水槽内有少量晶体析出
A.只有①③ B.只有①②③ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是( )
A.铁片改为铁粉 B.稀硫酸改为98% 浓硫酸
C.对该反应体系加热 D.铁片改为锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L 醋酸溶液B.0.01 mol/L NH4Cl 溶液
C.0.01 mol/L NaHSO4 溶液D.0.01 mol/L NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生的分解反应:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:
把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。
部分技术流程如下:
⑴合成塔中反应的化学方程式为____________;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了___________________________________________________________________。
(2)从合成塔分离出甲醇的原理与下列_______操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馈 D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
_______________________________________________________________________。
II.甲烷燃烧会放出大量的热,可作为能源应用于人类的生产和生活。
己知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l); △H1=-1214.6kJ/mol
②CO2(g)=CO(g)+1/2O2(g); △H2=+283.0kJ/mol
则表示甲烷燃烧热的热化学方程式______________________________。
III.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为_____________________。
(2)下列描述能说明反应达到平衡的是_______________________
A.装置内气体颜色不再改变 B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变 D.容器内气体密度保持不变
(3)该温度下平衡常数K=____,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将____ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO 2mol H2,此时CO的转化率将__________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为
A. 1010∶1 B. 5×109∶1 C. 108∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法不正确的是
A.油脂可以制肥皂
B.淀粉没有甜味,淀粉不属于糖类
C.粮食酿酒过程涉及水解、分解等反应
D.具有强氧化性的含氯消毒液可使新冠病毒变性失活
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com