
分析 (1)先根据尾气中二氧化氮和一氧化氮的关系计算二氧化氮、一氧化氮的物质的量,再根据方程式计算氨气和氧气的物质的量,最后根据M=$\frac{m}{n}$计算其平均相对分子质量;
(2)根据m=nM计算;
(3)根据V=nVm计算需要氨氧混合气体的体积;
(4)①c=$\frac{1000ρω}{M}$,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算;
②根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O中氮原子守恒计算NO和NO2的物质的量分别是多少,根据氧原子守恒解答.
解答 解:(1)设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,根据4NO+4NH3+O2$→_{140℃}^{催化剂}$4N2+6H2O知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式 6NO2+8NH3$→_{140℃}^{催化剂}$7N2+12H2O,0.015molNO2需要0.02molNH3,所以氮氧化物混合气体的平均摩尔质量为$\frac{0.015mol×46g/mol+0.06mol×30g/mol}{0.075mol}$=33.2g/mol,所以其相对分子质量为33.2,故答案为:33.2;
(2)1m3尾气中NO的物质的量为0.06mol,所以其m=nM=0.06mol×30g/mol=1800mg,故答案为:1800;
(3)处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,
故答案为:10.64;
(4)①c=$\frac{1000×1.28×25%}{40}$,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V=$\frac{0.5mol}{8mol/L}$=62.5mL,故答案为:8;62.5;
②2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,根据氮原子守恒知,生成0.35mol亚硝酸钠则生成0.15mol硝酸钠,生成0.15mol硝酸钠需要0.3mol二氧化氮,同时生成0.15mol亚硝酸钠,0.2mol亚硝酸钠需要0.1mol一氧化氮,所以二氧化氮的物质的量是0.4mol,根据氧原子守恒得x=$\frac{0.1×1+0.4×2}{0.5}$=1.8,故答案为:1.8.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中物质的量关系、物质的量的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
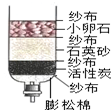
| A. | 该净水器中的活性炭起吸附作用 | B. | 该净水器可以降低自来水的硬度 | ||
| C. | 该净水器能起到杀菌消毒的作用 | D. | 该净水器可将自来水变为蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁的熔点比生铁要高 | |
| B. | 不能通过化合反应制得FeC12 | |
| C. | 地壳中含量铝比铁高,但在我国使用上铁比铝历史悠久 | |
| D. | Fe3O4既可以是铁与氧气反应的产物也可以是铁与水蒸气反应的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸和弱酸溶液的酸性 | |
| B. | 纯水在80℃和25℃的pH | |
| C. | 等物质的量的SO2和O2在一定条件下反应,两者的转化率 | |
| D. | 25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定其导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:1:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:2:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
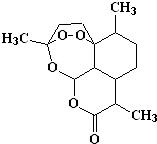
| A. | 青蒿素的化学式为C16H20O5 | |
| B. | 该有机物不能和NaOH溶液反应 | |
| C. | 青蒿素易溶于水 | |
| D. | 由于青蒿素中含有过氧键(-O-O-),具有较强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘化钾与氯气:5I-+3Cl2-+3H2O→IO3-+6Cl-+6H+ | |
| B. | KAl(SO4)2与Ba(OH)2:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O | |
| C. | 氨水与SO2:NH3•H2O+SO2→HSO3-+NH4+ | |
| D. | NaAlO2与AlCl3:Al3++3AlO2-+6H2O→4Al (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
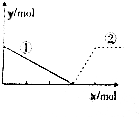 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化,其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化,其中正确的是( )| A. | ①Al3+ ②Al(OH)3 | B. | ①Al3+ ②AlO${\;}_{2}^{-}$ | ||
| C. | ①Al(OH)3 ②Al3+ | D. | ①AlO${\;}_{2}^{-}$ ②Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com