
下列叙述正确的是 ( )
A.NaCl溶液在电流的作用下电离为钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.尽管BaSO4难溶于水,但它仍然是强电解质
D.二氧化碳溶于水后能部分电离,所以二氧化碳是弱电解质
科目:高中化学 来源: 题型:
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中不正确的是
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 |
|
|
|
A.甲中反应的平衡常数小于乙 B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率: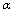 1<
1<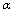 2 =
2 = 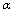 3 D.容器中SO3的物质的量浓度:丙=丁<甲
3 D.容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
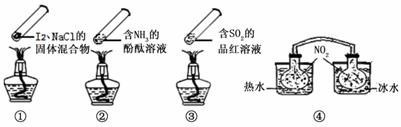
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是 ( )
A.在任何条件下,1mol任何气体的体积都约是22.4L
B.化学的特征就是认识分子和制造分子
C.在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和。
D.英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.NaHCO3的电离方程式为:NaHCO3=Na++H++CO32-
B.金属氧化物不一定是碱性氧化物
C.在碱性溶液中能大量共存的离子为:Fe3+、Na+、Cl-、SO42-
D.SO3溶于水,其水溶液能导电,SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是 ( )
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是元素周期表的一部分,下列关系正确的是
A.还原性:Se2->S2->C1- B. 热稳定性:HC1>H2Se>HBr
C.原子半径:Se>C1>S D. 酸性:HBrO4>HClO4>H2SO4
| S | Cl |
| Se | Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w= ×100% ②c=
×100% ②c=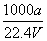 ③ ρ=17c/1000 w
③ ρ=17c/1000 w
④向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,因发生氧化还原反应而不能大量共存的是
A.K+、H+、I-、MnO4- B.Fe3+、Fe2+、SO42-、NO3- C.Al3+、Na+、SO42-、CO32- D.Fe3+、H+、SO42-、ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com