
| 高温 |
| V2O5 |
| △ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
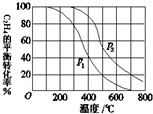 (1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属铝有好的导热性,常用铝箔做包装材料 |
| B、Al2O3是两性氧化物,常用其作耐火材料 |
| C、Al(OH)3能与胃液中的盐酸反应,可用其制作中和胃酸的药物 |
| D、明矾能吸附水中的悬浮物,可用其作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
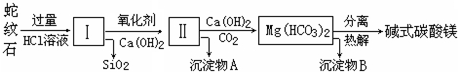
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
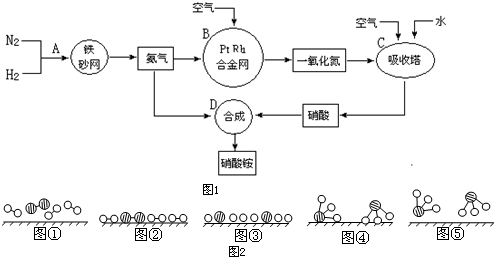
 分别表示N2、H2、NH3.
分别表示N2、H2、NH3.
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纯净物根据其组成和性质可进行如图所示分类
纯净物根据其组成和性质可进行如图所示分类| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com