
分析 化学反应速率表示单位时间内浓度的变化量,固体或纯液体的浓度一般视为常数,一般也不用固体或纯液体来表示反应速;计算B的反应速率,速率之比等于化学计量数之比计算得到C的反应速率.
解答 解:2min后B的浓度减小0.6mol/L,V(B)=$\frac{0.6mol/L}{2min}$=0.3mol/(L•min),
速率之比等于化学计量数之比计算得到C的反应速率V(C)=$\frac{2}{3}$V(B)=$\frac{2}{3}$×0.3mol/L•min=0.2mol/(L•min),
答:C的化学反应速率0.2mol/(L•min).
点评 本题考查了化学反应速率的概念分析计算,概念实质理解是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
 某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )
某温度时,Ag2SO4在水溶液中的溶解平衡曲线如图所示,下列说法不正确的是( )| A. | b点对应的Ksp(Ag2SO4)等于c点对应的Ksp(Ag2SO4) | |
| B. | 采取蒸发溶剂的犯法可以使a点对应的溶液变为b点对应的溶液 | |
| C. | 该温度下,Ksp(Ag2SO4)=1.6×10-5 | |
| D. | 0.02mol•L-1的AgNO3溶液与0.2mol•L-1的Na2SO4溶液等体积混合不会生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 等物质的量的水与重水含有相同数目的中子数 | |
| C. | 氯分子的电子式: | |
| D. | 恒温恒容条件下HI分解成气态I2的反应,体系的总压强保持不变时,说明反应处于平衡态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中通入CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| B. | 向Na2SO3溶液通入SO2:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 向CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| D. | 向NH4Cl溶液中通入NH3:c(NH4+)<c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
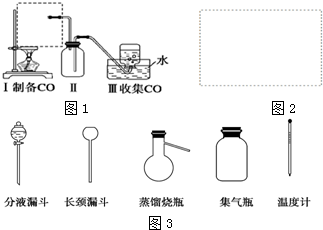
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com